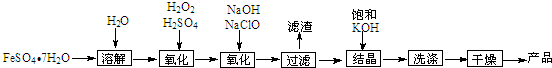
15. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,(填序号)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填序号)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,(填序号)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填序号)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
12.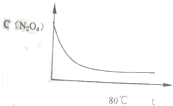 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A.N2O4的转化率越高 B.NO2的产量越大 C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施D
A.增大N2O4起始浓度 B.向混合气中通入NO2 C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度随时间t的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线.
0 173051 173059 173065 173069 173075 173077 173081 173087 173089 173095 173101 173105 173107 173111 173117 173119 173125 173129 173131 173135 173137 173141 173143 173145 173146 173147 173149 173150 173151 173153 173155 173159 173161 173165 173167 173171 173177 173179 173185 173189 173191 173195 173201 173207 173209 173215 173219 173221 173227 173231 173237 173245 203614
 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A.N2O4的转化率越高 B.NO2的产量越大 C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施D
A.增大N2O4起始浓度 B.向混合气中通入NO2 C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度随时间t的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线.
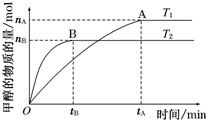 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题: