题目内容
14.一定的温度下,在一个固定体积的密闭容器内,加入1molA和1molB时,发生如下反应:2A(g)+B(g)--3C(g),达到平衡状态生成mmolC.在相同条件下,要保持平衡时的各物质的百分含量相同,则填写下列空白:①若开始时放入0.8molA、xmolB和0.3molC,则x=0.9mol.
②若开始时放入amolA、bmolB和cmolC,则a、b、c取值必须满足的一般条件是:a+$\frac{2}{3}$c=1,b+$\frac{1}{3}$c=1.
分析 一定的温度下,在一个固定体积的密闭容器内,加入1molA和1molB时,发生如下反应:2A(g)+B(g)?3C(g),达到平衡状态生成mmolC.在相同条件下,要保持平衡时的各物质的百分含量相同说明达到的是相同的平衡状态,
①起始量加入可以极值转化为起始量,当起始量“等量等效”达到相同平衡状态;
②依据起始量满足“等量等效”达到相同平衡状态分析查找的计算关系.
解答 解:一定的温度下,在一个固定体积的密闭容器内,加入1molA和1molB时,发生如下反应:2A(g)+B(g)?3C(g),达到平衡状态生成mmolC.在相同条件下,要保持平衡时的各物质的百分含量相同说明达到的是相同的平衡状态,
①若开始时放入0.8molA、xmolB和0.3molC,
2A(g)+B(g)?3C(g)
起始量(mol) 0.8 x 0.3
转化量(mol) 0.8+0.2 x+0.1 0
起始量加入可以极值转化为起始量,当起始量“等量等效”达到相同平衡状态,0.8mol+0.2mol=1mol,则x+0.1=1,满足平衡时的各物质的百分含量相同,
x=0.9mol,
故答案为:0.9;
②若开始时放入amolA、bmolB和cmolC,
2A(g)+B(g)?3C(g)
起始量(mol) a b c
转化量(mol) a+$\frac{2}{3}$c b+$\frac{1}{3}$c 0
依据起始量满足“等量等效”达到相同平衡状态分析查找的计算关系,则a、b、c取值必须满足的一般条件是a+$\frac{2}{3}$c=1,b+$\frac{1}{3}$c=1
故答案为:a+$\frac{2}{3}$c=1,b+$\frac{1}{3}$c=1.
点评 本题考查了化学平衡的分析判断,主要是等效平衡状态的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 刻度线 | B. | 容积 | C. | 压强 | D. | 温度 |
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2 | |
| B. | 氯化钡溶液中通入足量CO2:Ba2++CO2+H2O=BaCO3↓+2H+ | |
| C. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+=CO2↑+H2O | |
| D. | 澄清石灰水中滴入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |

| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | Na2CO3的热稳定性大于NaHCO3 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |

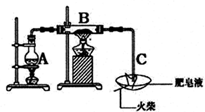 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).
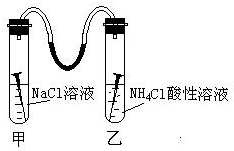 如图所示,甲、乙两试管中各放一枚铁钉,用装有少量水的玻璃弯管连接,甲试管中是NaCl溶液,乙试管中是NH4Cl溶液(显酸性),数天后,观察到的现象是:玻璃弯管液面左高右低(填高、低)请写出甲试管中正极反应式:O2+2H2O+4e-═4OH-.乙试管负极反应式
如图所示,甲、乙两试管中各放一枚铁钉,用装有少量水的玻璃弯管连接,甲试管中是NaCl溶液,乙试管中是NH4Cl溶液(显酸性),数天后,观察到的现象是:玻璃弯管液面左高右低(填高、低)请写出甲试管中正极反应式:O2+2H2O+4e-═4OH-.乙试管负极反应式