18.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 64 g SO2中含有的氧原子数为2NA | |
| B. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液,含有Cl-数目为1 NA | |
| C. | 常温常压下,14 g 氮气所含分子数为0.5 NA | |
| D. | 标准状况下,22.4 L 水所含水分子数为1NA |
17.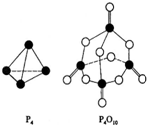 白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
 白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )| A. | 6a+5d<4c+10b | B. | △H=(4c+12b-6a-5d) kJ•mol-1 | ||
| C. | 6a+5d<4c+12b | D. | △H=(6a+5d-4c-12b) kJ•mol-1 |
16.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | H2(g)的燃烧热为285.8 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
14.下列离子的检验方法合理的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若有黄色火焰产生,该固体中一定含Na+,不含K+ | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明有Cl- |
13.将NO2和NH3混合,在一定条件下发生反应:6NO2+8NH3═7N2+12H2O,下列说法正确的是( )
| A. | NO2被氧化 | B. | NO2既是氧化剂,又是还原剂 | ||
| C. | NO2是氧化剂 | D. | 1mol NH3反应,转移3mol电子 |
12.由硫酸钾、硫酸铝和硫酸组成的混合溶液中,c(H+)=0.2mol•L-1,c(Al3+)=0.4 mol•L-1,c( SO${\;}_{4}^{2-}$)=0.8 mol•L-1,则c(K+)为( )
| A. | 0.15 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
11.下列物质中,属于电解质的是( )
0 173029 173037 173043 173047 173053 173055 173059 173065 173067 173073 173079 173083 173085 173089 173095 173097 173103 173107 173109 173113 173115 173119 173121 173123 173124 173125 173127 173128 173129 173131 173133 173137 173139 173143 173145 173149 173155 173157 173163 173167 173169 173173 173179 173185 173187 173193 173197 173199 173205 173209 173215 173223 203614
| A. | CO2 | B. | 盐酸 | C. | CaCO3 | D. | NaOH溶液 |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: