题目内容
17.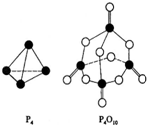 白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )| A. | 6a+5d<4c+10b | B. | △H=(4c+12b-6a-5d) kJ•mol-1 | ||
| C. | 6a+5d<4c+12b | D. | △H=(6a+5d-4c-12b) kJ•mol-1 |
分析 白磷分子为正四面体结构,每摩尔P4中含有6molP-P键,反应热△H=反应物总键能-生成物总键能,放热反应中△H<0,据此计算判断.
解答 解:白磷分子为正四面体结构,每摩尔P4中含有6molP-P键,白磷在氧气中燃烧涉及的各化学键键能为P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2$\frac{\underline{\;点燃\;}}{\;}$P4O10的反应热△H=6akJ•mol-1+5dkJ•mol-1-(4ckJ•mol-1+12bkJ•mol-1)=(6a+5d-4c-12b)kJ•mol-1,放热反应中△H<0,即6a+5d-4c-12b<0,所以6a+5d<4c+12b;
故选CD.
点评 本题考查反应热与化学键键能的关系,题目难度中等,注意从物质能量、键能理解反应热,注意每摩尔P4中含有6molP-P键.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
7.某同学进行家庭小实验,将选项中的物质与水充分混合,所得分散系不是溶液的是( )
| A. | 食盐 | B. | 植物油 | C. | 蔗糖 | D. | 酒精 |
8.下列物质中主要成分为硅酸盐的是( )
| A. | 硅橡胶 | B. | 石英 | C. | 青花瓷 | D. | 金刚砂 |
5.下列物质溶于水,其电离方程式正确的是( )
| A. | NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | B. | (NH4)2SO4═NH${\;}_{4}^{+}$+2SO${\;}_{4}^{2-}$ | ||
| C. | NaCl═Na++Cl- | D. | Ca(OH)2═Ca2++OH${\;}_{2}^{-}$ |
12.由硫酸钾、硫酸铝和硫酸组成的混合溶液中,c(H+)=0.2mol•L-1,c(Al3+)=0.4 mol•L-1,c( SO${\;}_{4}^{2-}$)=0.8 mol•L-1,则c(K+)为( )
| A. | 0.15 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
9.下列说法正确的是( )
| A. | 自发反应在任何条件下都能实现 | |
| B. | 化学反应不一定都有能量变化 | |
| C. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| D. | 一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率 |
6.下列说法中正确的是( )
| A. | 把98g硫酸溶于1 L水中,则溶液的物质的量浓度为1mol•L-1 | |
| B. | 1mol•L-1的NaCl溶液是指此溶液中含有1molNaCl | |
| C. | 1mol•L-1的CaCl2溶液中,Cl-的物质的量浓度为2mol•L-1 | |
| D. | 从100mL的1mol/L的硫酸溶液中取出10mL,则这10mL硫酸溶液的物质的量浓度是0.1mol/L |
7. 无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:
无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:
【查阅资料】
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是Fe2++MnO4-+H+
①${MnO}_{4}^{-}+{H}^{+}$→Fe3++Mn2+ (未配平)
【实验步骤】
称取0.790gKMnO4晶体,配成500.00mL水溶液;(已知Mr(KMnO4)=158)
②取除去糖衣(不与强氧化剂反应)后的硫酸亚铁补血剂药片(1.500g),研细后加稀硫酸溶解,配成100.00mL水溶液;
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中;
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积初始读数;
⑤滴定,并记录 KMnO4标准溶液的终点读数,再重复滴定2次.
【实验记录】
【交流与讨论】
(1)书写完整并配平离子反应5Fe2++1MnO4-+8H+→5Fe3++1Mn2++4H2O.
(2)配制KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有500mL容量瓶、胶体滴管(填仪器名称).
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是c(填字母序号).
(4)下列有关实验操作的描述及分析正确的是A(填字母序号).
A.配制KMnO4溶液时容量瓶洗涤后不需干燥即可直接用于实验
B.滴定过程中当观察到溶液颜色发生变化时应立即停止滴加,防止滴加过量
C.滴定过程中,左手控制滴定管,右手摇动锥形瓶,眼睛时刻关注着滴定管中读数变化
D.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则会使所测得的补血剂中铁元素的含量偏低
(5)根据实验数据,计算步骤②中所配制的硫酸亚铁溶液的浓度为0.0375mol/L,该补血剂中铁元素的质量分数为14%.(浓度计算结果保留四位有效数字)
 无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:
无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:【查阅资料】
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是Fe2++MnO4-+H+
①${MnO}_{4}^{-}+{H}^{+}$→Fe3++Mn2+ (未配平)
【实验步骤】
称取0.790gKMnO4晶体,配成500.00mL水溶液;(已知Mr(KMnO4)=158)
②取除去糖衣(不与强氧化剂反应)后的硫酸亚铁补血剂药片(1.500g),研细后加稀硫酸溶解,配成100.00mL水溶液;
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中;
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积初始读数;
⑤滴定,并记录 KMnO4标准溶液的终点读数,再重复滴定2次.
【实验记录】
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL (初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL (终读数) | 15.85 | 15.22 | 14.98 |
(1)书写完整并配平离子反应5Fe2++1MnO4-+8H+→5Fe3++1Mn2++4H2O.
(2)配制KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有500mL容量瓶、胶体滴管(填仪器名称).
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是c(填字母序号).
(4)下列有关实验操作的描述及分析正确的是A(填字母序号).
A.配制KMnO4溶液时容量瓶洗涤后不需干燥即可直接用于实验
B.滴定过程中当观察到溶液颜色发生变化时应立即停止滴加,防止滴加过量
C.滴定过程中,左手控制滴定管,右手摇动锥形瓶,眼睛时刻关注着滴定管中读数变化
D.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则会使所测得的补血剂中铁元素的含量偏低
(5)根据实验数据,计算步骤②中所配制的硫酸亚铁溶液的浓度为0.0375mol/L,该补血剂中铁元素的质量分数为14%.(浓度计算结果保留四位有效数字)