题目内容
20.同温同压下,同体积的A气体和H2的质量分别是4.8g和0.2g,则气体A的摩尔质量为48g/mol,A与氢气的物质的量之比为1:1.分析 同温同压下,同体积的A气体和H2的物质的量相等,根据n=$\frac{m}{M}$计算氢气物质的量,再根据M=$\frac{m}{n}$计算A的摩尔质量.
解答 解:同温同压下,同体积的A气体和H2的物质的量相等,二者物质的量之比为1:1,氢气物质的量为$\frac{0.2g}{2g/mol}$=0.1mol,则4.8g A的物质的量为0.1mol,故A的摩尔质量为$\frac{4.8g}{0.1mol}$=48g/mol,
故答案为:48 g/mol;1:1.
点评 本题考查阿伏伽德罗定律及其推论、物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
10.下列关于CaCO3的叙述错误的是( )
| A. | CaCO3俗名石灰石,属于碳酸盐 | |
| B. | CaCO3属于含氧酸盐 | |
| C. | 实验室用煅烧CaCO3来制备二氧化碳 | |
| D. | CaCO3 属于难溶性的钙盐 |
11.下列实验方法或操作能达到实验目的是( )
| A. |  收集SO2 收集SO2 | |
| B. | 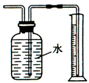 测量Cu与浓硝酸反应生成二氧化氮体积 测量Cu与浓硝酸反应生成二氧化氮体积 | |
| C. | 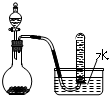 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. | 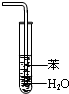 吸收HCl 吸收HCl |
9.表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 在18 g 18O2中含有NA个氧原子 | |
| B. | 1 mol FeI2与足量氯气反应对转移的电子数为2NA | |
| C. | 1 mol Cl2参加反应转移电子数一定为2 NA | |
| D. | 标准状况下,2.24L四氯化碳含有分子数目为0.1NA |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: