1.已知常温下在溶液中可发生如下两个离子反应:
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
| A. | Sn2+、Fe2+、Ge3+ | B. | Sn2+、Ge3+、Fe2+ | C. | Ge3+、Fe2+、Sn2+ | D. | Fe2+、Sn2+、Ge3+ |
20.下列事实与胶体性质无关的是( )
| A. | “尿毒症”患者做血液透析治疗 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 在豆浆里加入盐卤做豆腐 | |
| D. | 三氯化铁溶液中滴入氢氧化钠液出现红褐色沉淀 |
19.下列各组离子,在溶液中可以大量共存的是( )
| A. | OH-、SO${\;}_{4}^{2-}$、H+、Ba2+ | B. | Cl-、NO${\;}_{3}^{-}$、Ba2+、Ag+ | ||
| C. | H+、Na+、Cl-、CO${\;}_{3}^{2-}$ | D. | Na+、SO${\;}_{4}^{2-}$、K+、Cl- |
17.在2L绝热(不与外界交换能量)密闭容器中进行4A (g)+2B (g)?5C (g)+3D (s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.
①体系压强升高的理由是该反应为放热反应,温度升高气体的压强增大,
②该反应的平衡常数会随温度的降低而增大,(填“增大”“减小”或“无法确定”)理由是表格中起始投料表示反应总体向正反应方向进行,这会使气体的总物质的量减少,但气体的压强反而升高,说明该反应为放热反应,温度降低,平衡向正方向移动,平衡常数增大.
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
②该反应的平衡常数会随温度的降低而增大,(填“增大”“减小”或“无法确定”)理由是表格中起始投料表示反应总体向正反应方向进行,这会使气体的总物质的量减少,但气体的压强反而升高,说明该反应为放热反应,温度降低,平衡向正方向移动,平衡常数增大.
12.把足量铝条放入盛有一定体积的稀盐酸的试管中,能使反应速率降低且不影响氢气产生量的因素是( )
0 172993 173001 173007 173011 173017 173019 173023 173029 173031 173037 173043 173047 173049 173053 173059 173061 173067 173071 173073 173077 173079 173083 173085 173087 173088 173089 173091 173092 173093 173095 173097 173101 173103 173107 173109 173113 173119 173121 173127 173131 173133 173137 173143 173149 173151 173157 173161 173163 173169 173173 173179 173187 203614
| A. | 加入少量CuSO4溶液 | B. | 加入少量KNO3溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 加少量K2SO4溶液 |
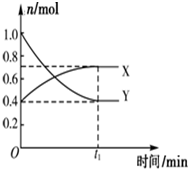 某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,
某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,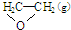 ),但是伴随副反应
),但是伴随副反应 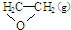 △H1
△H1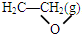 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.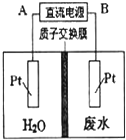 用如图所示装置处理含 NO${\;}_{3}^{-}$的酸性工业废水,某电极反应式为 2NO${\;}_{3}^{-}$+12H++10e-═N2↑+6H2O,请回答下列问题.
用如图所示装置处理含 NO${\;}_{3}^{-}$的酸性工业废水,某电极反应式为 2NO${\;}_{3}^{-}$+12H++10e-═N2↑+6H2O,请回答下列问题.  如图所示,是原电池的装置图,请回答:
如图所示,是原电池的装置图,请回答: