12.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:
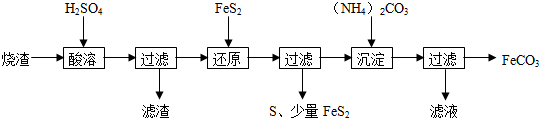
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是氢氧化铁.
(3)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++S2-=2Fe2++S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比(写出计算过程).

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是氢氧化铁.
(3)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++S2-=2Fe2++S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
8.下列有关物质用途的说法中,不正确的是( )
| A. | Fe2O3常用于制造红色油漆和涂料 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 氧化铝可用来制造耐高温的实验仪器 | |
| D. | 二氧化硅可用于制造光导纤维 |
7.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 二氧化硫与足量氢氧化钠溶液反应 SO2+2OHˉ=SO32-+H2O | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-═2A1O${\;}_{2}^{-}$+H2↑ |
6.下列化学用语表示正确的是( )
0 172929 172937 172943 172947 172953 172955 172959 172965 172967 172973 172979 172983 172985 172989 172995 172997 173003 173007 173009 173013 173015 173019 173021 173023 173024 173025 173027 173028 173029 173031 173033 173037 173039 173043 173045 173049 173055 173057 173063 173067 173069 173073 173079 173085 173087 173093 173097 173099 173105 173109 173115 173123 203614
| A. | 氮气的结构式:N≡N | |
| B. | Cl-的结构示意图: | |
| C. | 水的电子式: | |
| D. | 磷酸钠的电离方程式:Na3PO4=Na33++PO43- |
 .
. .
.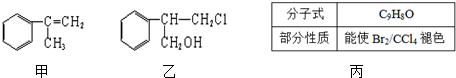
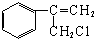 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙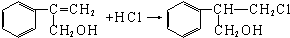 _(不需注明反应条件).
_(不需注明反应条件).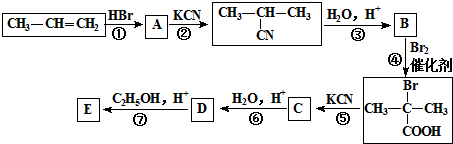
 ;
;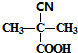
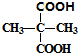 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$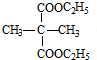 +2H2O.
+2H2O. 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 .
.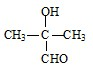 、
、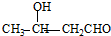 .
.