2. 在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
(1)试求CH3COOH的中和热△H=-53.3 kJ/mol.
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等.
(3)实验中NaOH过量的目的是使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度.
(4)CH3COOH的中和热与盐酸的中和热绝对值相比,HCl的较大,原因是CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热.
 在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 醋酸溶液 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 25.0 | 25.1 | 27.8 |
| 2 | 25.1 | 25.3 | 27.9 |
| 3 | 25.2 | 25.5 | 28.0 |
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等.
(3)实验中NaOH过量的目的是使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度.
(4)CH3COOH的中和热与盐酸的中和热绝对值相比,HCl的较大,原因是CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热.
20.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(7)小题用元素符号或化学式回答,(8)~(9)小题按题目要求回答.
(1)这九种元素分别为AHBNaCAlDCENFPGFHClINe.
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的是F.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G、H形成的化合物中,最稳定的HF.
(5)在B、C、E、F、G、H中,原子半径最大的是Na.
(6)A和D组成最简单化合物的电子式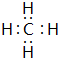 .
.
(7)A和E组成化合物的化学式NH3等.
(8)用电子式表示B和H组成化合物的形成过程 .
.
(9)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的是F.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G、H形成的化合物中,最稳定的HF.
(5)在B、C、E、F、G、H中,原子半径最大的是Na.
(6)A和D组成最简单化合物的电子式
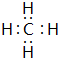 .
.(7)A和E组成化合物的化学式NH3等.
(8)用电子式表示B和H组成化合物的形成过程
 .
.(9)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
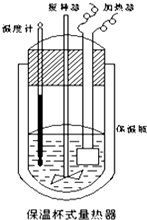
19.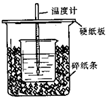 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②实验测得中和热数值比57.3kJ/mol小,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
16. 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.
(1)一定温度下,向容积恒为2L的密闭容器中通入3mol CO2,3mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.清回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L•min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2mol C-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
则反应CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=248kJ/mol.
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度.(写两点)
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②250℃与400℃时乙酸的生成速率相近,清分析判断实际生产选择的最佳温度是250℃.
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.(1)一定温度下,向容积恒为2L的密闭容器中通入3mol CO2,3mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.清回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L•min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2mol C-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度.(写两点)
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②250℃与400℃时乙酸的生成速率相近,清分析判断实际生产选择的最佳温度是250℃.
14.下表是元素周期表的一部分,其中a、b、c、d、e、f各代表一种元素,请回答下列问题:
(1)最简单的有机物是由b元素和a(填字母)元素组成的;
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为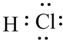 .
.
0 172910 172918 172924 172928 172934 172936 172940 172946 172948 172954 172960 172964 172966 172970 172976 172978 172984 172988 172990 172994 172996 173000 173002 173004 173005 173006 173008 173009 173010 173012 173014 173018 173020 173024 173026 173030 173036 173038 173044 173048 173050 173054 173060 173066 173068 173074 173078 173080 173086 173090 173096 173104 203614
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为
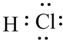 .
.  某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:
 .
.