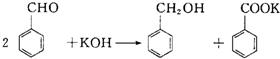
题目内容
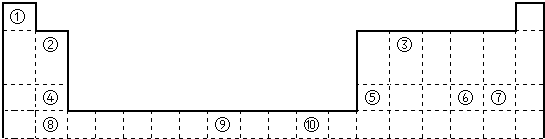
18.如图是元素周期表的一部分
(1)写出元素⑩的基态原子的电子排布式[Ar]3d64s2.焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一条反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.推测该分子的空间构型为平面三角形.
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中熔点最高的是NaH(写化合物的化学式).
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.请写出元素⑦的氢氧化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
分析 由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Na、⑦Al、⑧为Cl、⑨为Ti、⑩为Fe.
(1)⑩为Fe元素,原子核外有26个电子,根据构造原理书写基态原子的电子排布式;焊接钢轨时利用铝热反应,可以是Al与氧化铁在高温下反应生成氧化铝与Fe;
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物为HCHO;
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中NaH属于离子晶体,其它属于分子晶体,沸点最高为离子晶体;
(4)元素⑦的氢氧化物为Al(OH)3,与NaOH溶液反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Na、⑦Al、⑧为Cl、⑨为Ti、⑩为Fe.
(1)⑩为Fe元素,原子核外有26个电子,基态原子的电子排布式为[Ar]3d64s2;焊接钢轨时利用铝热反应,可以是Al与氧化铁在高温下反应生成氧化铝与Fe,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:[Ar]3d64s2;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物为HCHO,C碳原子形成3个σ键,没有孤电子对,故HCHO为平面三角形结构,故答案为:平面三角形;
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中NaH属于离子晶体,其它属于分子晶体,故沸点最高为NaH,故答案为:NaH;
(4)元素⑦的氢氧化物为Al(OH)3,与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表、核外电子排布、晶体类型与性质、分子结构、元素化合物性质等知识点,比较基础,注意对基础知识的理解掌握.

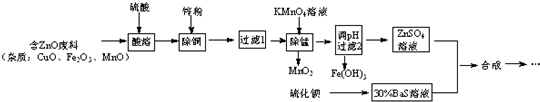
(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2,
(4)H2S+I2=S+2HI.
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
| A. | 1mol H2O中含有的原子数为NA | |
| B. | 2g H2中含有的氢原子数为2NA | |
| C. | 常温常压下,11.2L N2中含有的分子数为0.5N A | |
| D. | 1L 0.1 mol/L NaNO3溶液中含有的钠离子数为NA |
| A. | 二氧化硫在食品加工中可用作食品增白剂 | |
| B. | 航天飞机上的隔热陶瓷瓦属于复合材料 | |
| C. | 用活性炭做净化剂除去冰箱中异味 | |
| D. | 含H2SO4的废水用BaCl2处理后不可直接排放 |