12.A、B、C、D均为短周期元素,在周期表中的位置如图所示:
回答下列问题:
(1)A、B、D的元素符号为:C、N、Cl;C元素位于周期表中三周期VIA族.
(2)D的单质和水反应的化学方程式为:Cl2+H2O=HCl+HClO;
(3)D的最高价氧化物的水化物的化学式为:HClO4,其酸性大于(填大于或小于) C的最高价氧化物的水化物的酸性;B的氢化物的水溶液呈碱性(填酸性或碱性).
(4)A的氢化物的结构式为: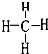 ,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
| A | B | |||
| C | D | |||
(1)A、B、D的元素符号为:C、N、Cl;C元素位于周期表中三周期VIA族.
(2)D的单质和水反应的化学方程式为:Cl2+H2O=HCl+HClO;
(3)D的最高价氧化物的水化物的化学式为:HClO4,其酸性大于(填大于或小于) C的最高价氧化物的水化物的酸性;B的氢化物的水溶液呈碱性(填酸性或碱性).
(4)A的氢化物的结构式为:
 ,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
10.已知氧化性Fe3+>I2.FeI2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++bI-+c Cl2→d Fe3++e I2+f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 0 1 2 0 2 | B. | 0 2 1 0 1 2 | ||
| C. | 2 4 3 2 2 6 | D. | 2 10 6 2 5 12 |
6.立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:
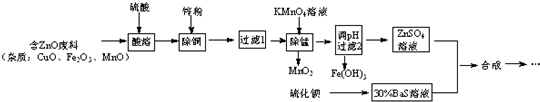
(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
实验中可选用的试剂:30% H2O2、3.0mol•L-1 H2SO4、1.0mol•L-1 NaOH.
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.
5.从一种生产醋酸乙烯酯的废触媒(含醋酸锌、活性炭及少量有机物及氧化亚铁)中制取氯化锌中实验步骤如图
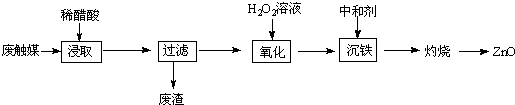
(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率;浸出率随着浸取时间先增大后又减小,其原因是开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小.
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是将吸附在活性炭孔内的醋酸锌全部释放出来.
(3)加入H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;沉铁需将溶液pH调整到约为5,最适宜的中和剂是bc(选填序号:a.石灰水 b.ZnO c.Zn.).
(4)高温灼烧时用到的硅酸盐质的仪器有酒精灯、坩埚和泥三角.
(5)某探究学习小组的同学拟利用废电池锌皮(主要成分为Zn,还含有少量的铁)制取氧化锌.如表列出了几种离子生成氢氧化物沉淀的pH:
实验中可选用的试剂:5mol•L-1HCl、2.0mol•L-1 HNO3、1.0mol•L-1 NaOH溶液.由废锌皮制ZnO的实验步骤依次为:向滤液中加入2.0mol•L-1 HNO3,使Fe2+转化完全为Fe3+,使其充分反应;滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,再经过滤、洗涤、干燥;900℃煅烧.

(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率;浸出率随着浸取时间先增大后又减小,其原因是开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小.
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是将吸附在活性炭孔内的醋酸锌全部释放出来.
(3)加入H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;沉铁需将溶液pH调整到约为5,最适宜的中和剂是bc(选填序号:a.石灰水 b.ZnO c.Zn.).
(4)高温灼烧时用到的硅酸盐质的仪器有酒精灯、坩埚和泥三角.
(5)某探究学习小组的同学拟利用废电池锌皮(主要成分为Zn,还含有少量的铁)制取氧化锌.如表列出了几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
3.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
0 172909 172917 172923 172927 172933 172935 172939 172945 172947 172953 172959 172963 172965 172969 172975 172977 172983 172987 172989 172993 172995 172999 173001 173003 173004 173005 173007 173008 173009 173011 173013 173017 173019 173023 173025 173029 173035 173037 173043 173047 173049 173053 173059 173065 173067 173073 173077 173079 173085 173089 173095 173103 203614
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
 B(OH)4-+H+;
B(OH)4-+H+;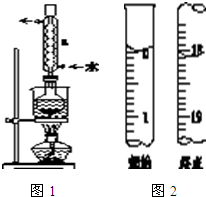 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. 氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:
氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下: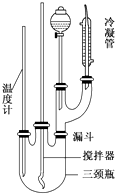 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: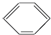 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ +H2O△H<0
+H2O△H<0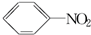 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$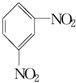 +H2O
+H2O