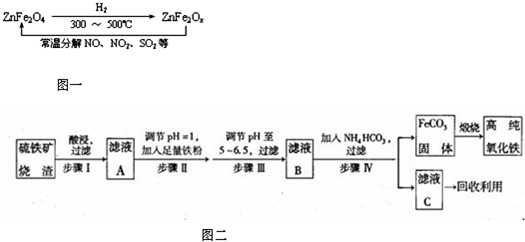
5. 实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
(1)a装置的名称是滴液漏斗(分液漏斗),B中安装导管b 的作用是防止D发生堵塞时出现危险(平衡装置内气压),在加热A过程中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是b;(填正确选项前的字母)
a.引发反应 b.减少副产物乙醚生成 c.防止乙醇挥发
(2)在装置C中应加入氢氧化钠溶液,其目的是吸收反应中可能生成的酸性气体SO2和CO2.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、下“);
(4)若产物中溶有少量副产物乙醚,可用蒸馏的方法除去;
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是温度太低,1,2-二溴乙烷容易凝固发生堵塞,不安全.
 实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:(1)a装置的名称是滴液漏斗(分液漏斗),B中安装导管b 的作用是防止D发生堵塞时出现危险(平衡装置内气压),在加热A过程中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是b;(填正确选项前的字母)
a.引发反应 b.减少副产物乙醚生成 c.防止乙醇挥发
(2)在装置C中应加入氢氧化钠溶液,其目的是吸收反应中可能生成的酸性气体SO2和CO2.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、下“);
(4)若产物中溶有少量副产物乙醚,可用蒸馏的方法除去;
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是温度太低,1,2-二溴乙烷容易凝固发生堵塞,不安全.
| 本题中出现有机物相关数据 | |||
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
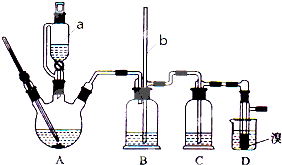
2.一氧化二氯(Cl2O)是黄棕色具有强烈刺激性气味的气体.它的熔点为-116℃,沸点是3.8℃.一氧化二氯不稳定,接触一般有机物易发生爆炸;它易溶于水(1体积:100体积)同时反应形成次氯酸溶液.制备出一氧化二氯之后,要冷却为固态才便于操作和贮存,制取少量一氧化二氯,是用干燥的氧化汞与氯气反应(同时还生成HgO•HgCl2).制备装置如图所示,铁架台和夹持仪器已略去.

部分物质的有关资料如下:
试回答:
(1)试说明加入试剂前检验A、B、C处仪器气密性的操作方法先关闭分液漏斗上的活塞及关闭开关N的活塞,将M管口插入盛有水的水槽中,给A处的圆底烧瓶微热,若管口M处有气泡冒出,停止加热M处有液柱上升,证明A、B、C处的装置气密性良好.
(2)A中盛有的深色固体试剂a应是高锰酸钾,分液漏斗中的b试剂是浓盐酸.
(3)B中盛有的液体C应是饱和食盐水,C中的液体d是浓硫酸.
(4)D中发生反应的化学方程式是2HgO+2Cl2=Cl2O+HgO•HgCl2.
(5)E中的保温瓶中盛有液态致冷剂c,它应是液态空气(在“干冰”、“冰水”、“液态空气”、“液氨”、“液氯”中选择一种).在E的内管得到的Cl2O中可能含有的杂质主要是液氯.
(6)装置A、B、C间的连接方式与D、E间的连接方式有明显的差别,这区别是A、B、C间用乳胶管连接,D、E间不能乳胶管连接,用这种不同的连接方式的主要理由是Cl2O遇有机物易爆炸.

部分物质的有关资料如下:
| 化学式 | N2 | O2 | CO2 | NH3 | Cl2 |
| 熔点(℃) | -209.86 | -218.4 | -78.5 | -77.3 | -101 |
| 沸点(℃) | -195.8 | -183 | -33.35 | -34.6 |
(1)试说明加入试剂前检验A、B、C处仪器气密性的操作方法先关闭分液漏斗上的活塞及关闭开关N的活塞,将M管口插入盛有水的水槽中,给A处的圆底烧瓶微热,若管口M处有气泡冒出,停止加热M处有液柱上升,证明A、B、C处的装置气密性良好.
(2)A中盛有的深色固体试剂a应是高锰酸钾,分液漏斗中的b试剂是浓盐酸.
(3)B中盛有的液体C应是饱和食盐水,C中的液体d是浓硫酸.
(4)D中发生反应的化学方程式是2HgO+2Cl2=Cl2O+HgO•HgCl2.
(5)E中的保温瓶中盛有液态致冷剂c,它应是液态空气(在“干冰”、“冰水”、“液态空气”、“液氨”、“液氯”中选择一种).在E的内管得到的Cl2O中可能含有的杂质主要是液氯.
(6)装置A、B、C间的连接方式与D、E间的连接方式有明显的差别,这区别是A、B、C间用乳胶管连接,D、E间不能乳胶管连接,用这种不同的连接方式的主要理由是Cl2O遇有机物易爆炸.
9.镍具有优良的物理和化学特性,是高技术产业的重要材料,羰基法提纯粗粗镍涉及的反应为Ni(s)+4CO(g)$\stackrel{50℃}{?}$Ni(CO)4(g).已知该反应的平衡常数K随温度T的变化如下表所示:
试回答下列问题:
(1)升高温度,Ni的转化率减小(填“增大”“减小”或“不变”).
(2)在保持温度不变的情况下,要提高上述反应中Ni的转化率,可采取的一种措施是增大压强或降低温度或增加一氧化碳的浓度.
| T/℃ | 25 | 80 | 230 |
| K | 5×104 | 1 | 2×10-5 |
(1)升高温度,Ni的转化率减小(填“增大”“减小”或“不变”).
(2)在保持温度不变的情况下,要提高上述反应中Ni的转化率,可采取的一种措施是增大压强或降低温度或增加一氧化碳的浓度.
8.荧火黄既可用作颜料,也用作指示剂,其合成路线如下图:
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 1 mol荧火黄完全燃烧消耗标准状况下氧气体积为459.2L | |
| B. | 荧火黄分子中含有两种含氧官能团 | |
| C. | 1 mol荧火黄最多可与含4 mol NaOH的溶液完全反应 | |
| D. | 荧火黄的分子式为C20H14O5 |
7.苯是一种重要的化工原料,由苯可以合成大量的有重要工业用途的芳香族化合物,如:
下列说法正确的是( )
0 172871 172879 172885 172889 172895 172897 172901 172907 172909 172915 172921 172925 172927 172931 172937 172939 172945 172949 172951 172955 172957 172961 172963 172965 172966 172967 172969 172970 172971 172973 172975 172979 172981 172985 172987 172991 172997 172999 173005 173009 173011 173015 173021 173027 173029 173035 173039 173041 173047 173051 173057 173065 203614

下列说法正确的是( )
| A. | 反应①、②、③、④均属于取代反应 | |
| B. | 1,2-二苯乙烯分子中所有原子可能处于同一平面上 | |
| C. | 联二苯一氯取代产物有6种 | |
| D. | 鉴别苯、乙苯、1,2-二苯乙烯可用溴水和酸性高锰酸钾溶液 |
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究: