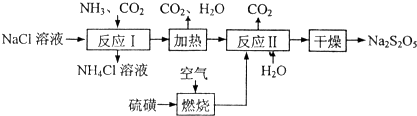
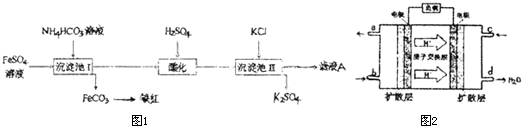
题目内容
3.工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液,绿矾晶体FeSO4•7H2O和胆矾晶体CuSO4•5H2O,设计了如下方案: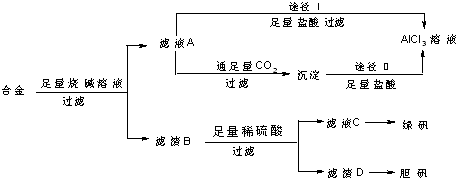
请回答相关问题:
(1)写出合金溶于足量烧碱溶液时相关反应的离子反应方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.写出途径Ⅰ中相关反应的离子反应方程式:AlO2-+4H+═Al3++2H2O、H++OH-═H2O.
(2)由滤液A得到AlCl3溶液的途径有Ⅰ和Ⅱ两种,你认为合理的是途径(填“Ⅰ”或“Ⅱ”)理由是Ⅱ,因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入CO2气体,得Al(OH)3 沉淀,将Al(OH)3溶解于盐酸中得到的是较纯净的AlCl3溶液;.
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,写出稀硫酸和H2O2溶解滤渣D的离子反应方程式:Cu+H2O2+2H+═Cu2++2H2O.
(4)如何在实验室从滤液C中获得绿矾晶体(写出主要的实验操作名称)蒸发浓缩、冷却结晶.
分析 流程题的关键是明确流程中每一步的反应过程,前后连贯综合考虑解答问题,铝、铁、铜的合金中加入足量烧碱溶液过滤,得到滤液A为偏铝酸钠溶液,滤渣B为铁和铜,由滤液A加入足量盐酸反应制取AlCl3溶液,同时A中含有Na+,该途径是不行的,制取的AlCl3中含有杂质;滤液A中通入足量二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到沉淀中加入足量盐酸加热通过途径Ⅱ得到氯化铝溶液;滤渣B中加入足量硫酸溶液铁反应生成硫酸亚铁溶液,铜不反应,过滤得到滤液C为硫酸亚铁溶液,从滤液C中获得绿矾晶体注意的是冷却结晶,不是蒸发结晶,滤渣D为铜,通过氧化生成氧化铜,氧化铜和硫酸反应生成硫酸铜溶液,浓缩蒸发,冷却结晶,过滤洗涤得到胆矾,
(1)合金溶于足量烧碱溶液时发生反应生成偏铝酸钠和氢气,途径I中是过量氢氧化钠和盐酸发生反应生成氯化钠和水,偏铝酸钠溶液和盐酸反应得到氯化铝、氯化钠的混合溶液;
(2)由滤液A得AlCl3溶液的途径有I和II两种,分析可知由滤液A加入足量盐酸反应制取AlCl3溶液,同时A中含有Na+,该途径Ⅰ是不行的,途径Ⅱ可以得到氯化铝溶液;
(3)在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,铜和过氧化氢扎起稀硫酸溶液中发生氧化还原反应生成硫酸铜溶液;
(4)利用溶液中溶质分离的方法回答,硫酸亚铁溶液蒸发浓缩,冷却结晶,过滤洗涤得到晶体.
解答 解:(1)合金溶于足量烧碱溶液时发生反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,途径I中是过量氢氧化钠和盐酸发生反应生成氯化钠和水,反应的离子方程式为:H++OH-═H2O,偏铝酸钠溶液和盐酸反应得到氯化铝、氯化钠的混合溶液,反应的离子方程式为:AlO2-+4H+═Al3++2H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+4H+═Al3++2H2O、H++OH-═H2O;
(2)滤液A为偏铝酸钠溶液,滤渣B为铁和铜,由滤液A加入足量盐酸反应制取AlCl3溶液,同时A中含有Na+,该途径是不行的,制取的AlCl3中含有杂质;滤液A中通入足量二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到沉淀中加入足量盐酸加热通过途径Ⅱ得到氯化铝溶液,途径Ⅱ更合理,因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入CO2气体,得Al(OH)3 沉淀,将Al(OH)3溶解于盐酸中得到的是较纯净的AlCl3溶液;
故答案为:Ⅱ;因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入CO2气体,得Al(OH)3 沉淀,将Al(OH)3溶解于盐酸中得到的是较纯净的AlCl3溶液;
(3)H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体,稀硫酸和H2O2溶解滤渣D的离子方程式为:Cu+H2O2+2H+═Cu2++2H2O,故答案为:Cu+H2O2+2H+═Cu2++2H2O;
(4)从滤液C中获得绿矾晶体,硫酸亚铁溶液蒸发浓缩,冷却结晶,过滤洗涤得到晶体,
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查了物质性质的分析,流程分析判断,主要是物质性质转化的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 乙烷的结构式:C2H6 | |
| B. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| C. | 乙炔的电子式: | |
| D. | 乙醇分子的比例模型: |
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | Na投入H2O中:2Na+2H2O═2Na++2OH-+H2↑ |

下列说法正确的是( )
| A. | 反应①、②、③、④均属于取代反应 | |
| B. | 1,2-二苯乙烯分子中所有原子可能处于同一平面上 | |
| C. | 联二苯一氯取代产物有6种 | |
| D. | 鉴别苯、乙苯、1,2-二苯乙烯可用溴水和酸性高锰酸钾溶液 |
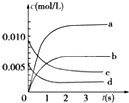 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内温度保持不变.