8.下列说法或表述正确的是( )
| A. | 16O与18O互为同位素,H218O与D218O互为同素异形体,甲醇、乙二醇与丙三醇互为同系物 | |
| B. | 在SiO2晶体中,一个Si原子和2个O原子形成两个共价键 | |
| C. | 1L0.5mol/L 稀硫酸与1L 1mol/L 氢氧化钠溶液反应放出57.3kJ的热:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6 kJ/mol | |
| D. | 碳酸钠水溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- |
6.下表列出了A~R九种元素在周期表的位置,用化学用语回答下列问题:
(1)写出R单质分子的电子式 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH
(3)A、B、C、G的离子按离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅢA族.
(6)有两种化合物M和N都由AFIJ四种元素组成.若M与N在水溶液中能发生离子反应,则该反应的离子方程式为HSO3-+H+=H2O+SO2↑.
(7)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH
(3)A、B、C、G的离子按离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅢA族.
(6)有两种化合物M和N都由AFIJ四种元素组成.若M与N在水溶液中能发生离子反应,则该反应的离子方程式为HSO3-+H+=H2O+SO2↑.
(7)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
4. 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
合成反应: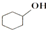 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:| 相对分子质量 | 密度(g•cm-3) | 沸点(℃) | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
3.某NaNO3溶液中混有少量NaCl,Na2SO4和Na2CO3杂质,为除去这些杂质,仅提供3种药品:AgNO3溶液、BaCl2溶液和稀HCl.请只取一份溶液,设计合理的顺序将杂质逐一除去,并填写下面实验报告.(简要回答.每次加入的试剂都是适量的)
| 实验步骤 | 加入试剂 | 离子方程式 |
| (1) | 稀HCl | CO32-+2H+=CO2↑+H2O |
| (2) | BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
| (3) | AgNO3溶液 | Ag++Cl-=AgCl↓ |
2.下列除去杂质所选试剂和方法均正确的是( )
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |
20.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )

0 172681 172689 172695 172699 172705 172707 172711 172717 172719 172725 172731 172735 172737 172741 172747 172749 172755 172759 172761 172765 172767 172771 172773 172775 172776 172777 172779 172780 172781 172783 172785 172789 172791 172795 172797 172801 172807 172809 172815 172819 172821 172825 172831 172837 172839 172845 172849 172851 172857 172861 172867 172875 203614

| A. | 原子半径大小比较为A>B>C>D | B. | 生成的氢化物稳定性为A>B>C>D | ||
| C. | A与C形成的阴离子可能有AC${\;}_{3}^{2-}$ | D. | A、B、C、D的单质常温下均不导电 |


