9.某温度下,体积一定的密闭容器中进行如下反应X(g)+Y(g)?2Z(g)+W(s)△H>0下列叙述正确的是( )
| A. | 当容器中气体的平均摩尔质量不变时,反应达到了平衡 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 平衡后加入X,上述反应的△H增大 |
8.对于反应:A+B=C下列条件的改变一定能使化学反应速率加快的是( )
| A. | 增加A的物质的量 | B. | 升高体系温度 | ||
| C. | 增加体系压强 | D. | 减少C的物质的量浓度 |
7.氢气是21世纪最理想的能源,其根据不正确的是( )
| A. | 生产氢气的原料来源广泛 | |
| B. | 氢气燃烧时无污染 | |
| C. | 氢气易液化,贮存、携带方便 | |
| D. | 在等质量的可燃气体中,氢气燃烧时放出的热量多 |
20.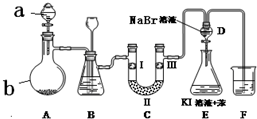 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
0 172565 172573 172579 172583 172589 172591 172595 172601 172603 172609 172615 172619 172621 172625 172631 172633 172639 172643 172645 172649 172651 172655 172657 172659 172660 172661 172663 172664 172665 172667 172669 172673 172675 172679 172681 172685 172691 172693 172699 172703 172705 172709 172715 172721 172723 172729 172733 172735 172741 172745 172751 172759 203614
 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
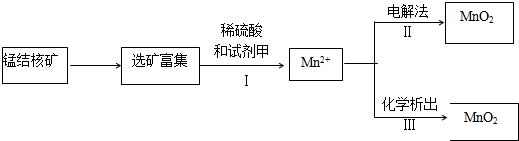
 二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.
二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.
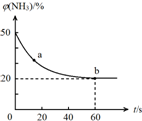 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.