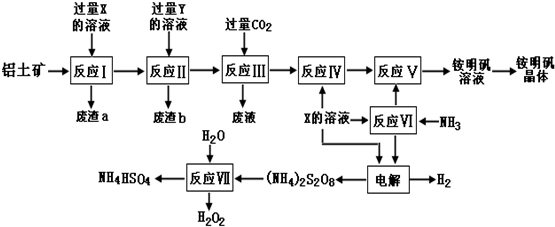
10.5.4g M和16.0g N恰好完全反应,生成0.2mol X和10.2gY,则X的摩尔质量为( )
| A. | 56 | B. | 56 g•mol-1 | C. | 28 | D. | 28 g•mol -1 |
9.下列离子方程式中书写正确的是( )
| A. | 硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
4. 如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
 如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
3.下列离子方程式中正确的是( )
0 172490 172498 172504 172508 172514 172516 172520 172526 172528 172534 172540 172544 172546 172550 172556 172558 172564 172568 172570 172574 172576 172580 172582 172584 172585 172586 172588 172589 172590 172592 172594 172598 172600 172604 172606 172610 172616 172618 172624 172628 172630 172634 172640 172646 172648 172654 172658 172660 172666 172670 172676 172684 203614
| A. | 铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| B. | 向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
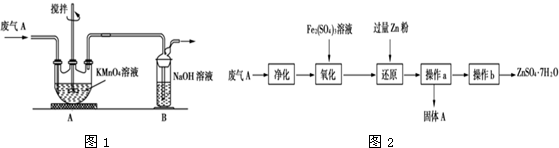
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: