4.25℃时,用0.1mol•L-1的CH3COOH溶液滴定20mL0.1mol•L-1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是( )
| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1Ka-2}$ | ||
| C. | K a=$\frac{2×1{0}^{-7}}{V+20}$ | D. | K a=$\frac{2×1{0}^{-8}}{V}$ |
3.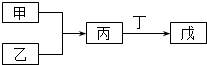 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )| A. | 若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物 | |
| B. | 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 | |
| C. | 若丙、丁混合产生大量白烟,则乙可能具有漂白性 | |
| D. | 若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
2.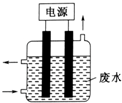 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 可以用石墨作阳极,作铁阴极 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH-+2e-═ClO-+H2O | |
| D. | 阳极的电极反应式为:2CN-+12OH--10e-═N2↑+2CO32-+6H2O |
1.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. | 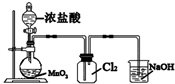 实验室制取Cl2 | D. | 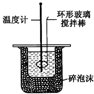 中和热的测定 |
20.下列说法正确的是( )
| A. | SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 | |
| B. | 由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 | |
| C. | 稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 | |
| D. | 金属钠通常被保存在煤油或石蜡油中,以隔绝空气 |
19.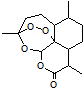 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 每个分子中含有4个六元环 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
17.发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭为液态H2和液态O2,发生的反应为2H2(g)+O2(g)═2H2O(g).下列说法正确的是( )
| A. | 化合反应都是放热反应 | |
| B. | 2 mol气态H2与1 mol气态O2的总能量小于2 mol水蒸气的总能量 | |
| C. | 断裂2 mol氢-氢键、1 mol氧-氧键吸收的总能量大于形成4 mol H-O释放的总能量 | |
| D. | 氢气燃烧过程能量变化可用右图表示 |
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 46 g NO2含有氧原子数为2NA | |
| B. | 常温常压下,22.4 L N2含有的分子数为NA | |
| C. | 1 L 1 mol•L-1 Al2(SO4)3溶液中含SO${\;}_{4}^{2-}$数目为NA | |
| D. | 1 mol Fe在足量Cl2中燃烧,转移电子数为2NA |
15.下列属于取代反应的是( )
0 172456 172464 172470 172474 172480 172482 172486 172492 172494 172500 172506 172510 172512 172516 172522 172524 172530 172534 172536 172540 172542 172546 172548 172550 172551 172552 172554 172555 172556 172558 172560 172564 172566 172570 172572 172576 172582 172584 172590 172594 172596 172600 172606 172612 172614 172620 172624 172626 172632 172636 172642 172650 203614
| A. | H2C═CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | |
| C. | 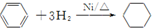 | |
| D. | 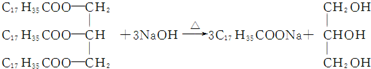 |
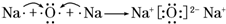 .A、B两种元素还可以形成A2B2型化合物,写出该化合物的电子式
.A、B两种元素还可以形成A2B2型化合物,写出该化合物的电子式 .
. ;
;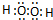 ;
; .
.