9. 甲醇与水蒸气反应:CH3OH(g)+H2O$\stackrel{催化剂}{?}$CO2(g)+3H2(g).
甲醇与水蒸气反应:CH3OH(g)+H2O$\stackrel{催化剂}{?}$CO2(g)+3H2(g).
(1)在某温度下,测得H2O(g)和CH3OH(g)的浓度随时间变化如表.
①0~10min内的平均速率v(H2O)=0.02 mol•L-1•min-1.
②平衡时CH3OH的转化率=50%.
③该温度下,此反应的平衡常数K=1.35.
(2)为了探究不同催化剂、温度对化学反应速率的影响,设计了3组实验,所得实验曲线如图所示.
①补充完成表格中的实验条件数据:X280Y1.00Z3.00.
②以上甲醇与水蒸气反应的△H>0(填“>”、“<”或“=”)
③根据以上探究,该反应的最佳条件是380℃,ZrO2做催化剂.
 甲醇与水蒸气反应:CH3OH(g)+H2O$\stackrel{催化剂}{?}$CO2(g)+3H2(g).
甲醇与水蒸气反应:CH3OH(g)+H2O$\stackrel{催化剂}{?}$CO2(g)+3H2(g).(1)在某温度下,测得H2O(g)和CH3OH(g)的浓度随时间变化如表.
| 0min | 10min | 20min | 60min | 70min | |
| c(H2O)/mol•L-1 | 3.00 | 2.80 | 2.65 | 2.50 | 2.50 |
| c(CH3OH)/mol•L-1 | 1.00 | 0.80 | 0.65 | 0.50 | 0.50 |
②平衡时CH3OH的转化率=50%.
③该温度下,此反应的平衡常数K=1.35.
(2)为了探究不同催化剂、温度对化学反应速率的影响,设计了3组实验,所得实验曲线如图所示.
| 实验编号 | T/℃ | c(CH3OH)/mol•L-1 | c(H2O)/mol•L-1 | 催化剂 |
| Ⅰ | 280 | 1.00 | 3.00 | CuO |
| Ⅱ | X | 1.00 | 3.00 | ZrO2 |
| Ⅲ | 380 | Y | Z | ZrO2 |
②以上甲醇与水蒸气反应的△H>0(填“>”、“<”或“=”)
③根据以上探究,该反应的最佳条件是380℃,ZrO2做催化剂.
6. 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| I | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.9mol | - |
| A. | 实验I中,lOmin 内平均速率v(B)=0.06mol•L-1•min-1 | |
| B. | 600℃时,上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 800℃时,在原容器中充入 1molA、0.5molB、1molC、0.5molD,则v(正)<v(逆) |
4.碳的化合物与人类生产、生活密切相关.
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表.
则该温度下反应的平衡常数K=$\frac{2}{3}$.
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2molH2,此时v(正)=v(逆),则x、y的关系式是x:y=3:1.
Ⅱ.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180-200℃}^{50-80℃}$Ni(CO)4(g),则△H<0,(填“>”、“<”);缩小容器容积,平衡向右(填“左”或“右”)移动,△H不变(填“增大”、“减少”或“不变”,下同),混合气体的密度增大.
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表.
| T/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1 | 0.8 | 0.65 | 0.6 | 0.6 |
| n(CO)/mol | 0.8 | 0.6 | 0.45 | 0.4 | 0.4 |
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2molH2,此时v(正)=v(逆),则x、y的关系式是x:y=3:1.
Ⅱ.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180-200℃}^{50-80℃}$Ni(CO)4(g),则△H<0,(填“>”、“<”);缩小容器容积,平衡向右(填“左”或“右”)移动,△H不变(填“增大”、“减少”或“不变”,下同),混合气体的密度增大.
2. 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
实验中可能用到的数据如表:
①合成反应:在仪器A中加入适量NaBr、1:1浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物.
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)配制体积比1:1的硫酸所用的定量仪器为b(选填编号).
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)仪器A中发生的反应为:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O.(用一条方程式表示)
(3)仪器B的名称是蒸馏烧瓶,冷水进口是b(填“a”或“b”).
(4)制备时,需将仪器C置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)上述装置中的仪器连接部分都为玻璃接口的原因是:反应会产生Br2,腐蚀橡胶.
(6)溴乙烷粗产品可能混有多种杂质,若仪器A中获得的有机物呈棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
加水的目的是为了除除去溶解在溴乙烷中乙醇.
(7)该实验所得溴乙烷的产率为79%.(保留两位有效数字)
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:实验中可能用到的数据如表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)配制体积比1:1的硫酸所用的定量仪器为b(选填编号).
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)仪器A中发生的反应为:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O.(用一条方程式表示)
(3)仪器B的名称是蒸馏烧瓶,冷水进口是b(填“a”或“b”).
(4)制备时,需将仪器C置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)上述装置中的仪器连接部分都为玻璃接口的原因是:反应会产生Br2,腐蚀橡胶.
(6)溴乙烷粗产品可能混有多种杂质,若仪器A中获得的有机物呈棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
加水的目的是为了除除去溶解在溴乙烷中乙醇.
(7)该实验所得溴乙烷的产率为79%.(保留两位有效数字)
4.某物质属于电解质,则该物质不可能属于( )
0 172344 172352 172358 172362 172368 172370 172374 172380 172382 172388 172394 172398 172400 172404 172410 172412 172418 172422 172424 172428 172430 172434 172436 172438 172439 172440 172442 172443 172444 172446 172448 172452 172454 172458 172460 172464 172470 172472 172478 172482 172484 172488 172494 172500 172502 172508 172512 172514 172520 172524 172530 172538 203614
| A. | 金属氧化物 | B. | 强碱 | C. | 单质 | D. | 正盐 |


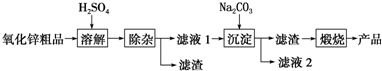
 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: 已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图:
已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图: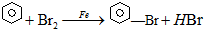 .;
.;