11.对于某些离子的检验及结论一定正确的是( )
| A. | 向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+ | |
| C. | 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+ |
10.若NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 等物质的量的N2与O2中的所含分子数均为NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| C. | 常温常压下,22gCO2含有的原子数为1.5NA | |
| D. | 1mol/L NaOH溶液中含有的Na+的数目为NA |
9.下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是 ( )
| A. | 石灰水和稀盐酸混合 | |
| B. | 小苏打溶液和柠檬水混合 | |
| C. | 人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合 | |
| D. | 氯化钠溶液和蔗糖水混合 |
8.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A. | 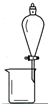 用CCl4提取溴水中的Br2 用CCl4提取溴水中的Br2 | B. |  从KI和I2的固体混合物中回收I2 从KI和I2的固体混合物中回收I2 | ||
| C. | 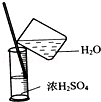 稀释浓硫酸 稀释浓硫酸 | D. | 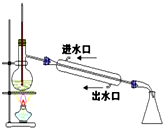 工业酒精制备无水酒精 工业酒精制备无水酒精 |
7.下列物质在水溶液中的电离方程式正确的是( )
| A. | NaHSO4═Na++HSO4- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | NH4Cl═NH3+H++Cl- | D. | H2CO3═2H++CO32- |
6.(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol/L.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B═H++HB- HB-?H++B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
( III)已知:25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9.
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂.胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动.
万一误服了少量BaCO3,应尽快用大量0.5mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为2×10-10mol/L.
| 实验 编号 | HA的物质的量 浓度(mol/L) | NaOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol/L.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B═H++HB- HB-?H++B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
( III)已知:25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9.
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂.胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动.
万一误服了少量BaCO3,应尽快用大量0.5mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为2×10-10mol/L.
4.下列有关说法正确的是( )
0 172342 172350 172356 172360 172366 172368 172372 172378 172380 172386 172392 172396 172398 172402 172408 172410 172416 172420 172422 172426 172428 172432 172434 172436 172437 172438 172440 172441 172442 172444 172446 172450 172452 172456 172458 172462 172468 172470 172476 172480 172482 172486 172492 172498 172500 172506 172510 172512 172518 172522 172528 172536 203614
| A. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 将纯水加热至较高温度,KW变大、pH变小、呈酸性 | |
| D. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |