9.在下列溶液中,各组离子一定能大量共存的是( )
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
8.设NA为阿伏伽德罗常数的值,下列叙述一定正确的是( )
| A. | 标准状况下,5.6L SO3含有的分子数为0.25NA | |
| B. | 标况下,0.1mol苯中含有C=C键数目为0.3NA | |
| C. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
7.下列有关物质性质和应用都正确的是( )
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 明矾净水是因为Al(OH)3胶体能消毒 | |
| C. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 | |
| D. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
4.短周期元素A、M、X、Y、Z、E的原子序数依次增大,其元素特征信息如下表
(1)M与X形成的化合物X2M2中含有的化学键为离子键、共价键;X、Y的最高价氧化物对应的水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(用元素符号表示,下同)
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
(4)X、Y、Z、E四种元素简单离子的离子半径由小到大的顺序是r (Al3+)<r (Na+)<r (Cl-)<r (S2-).
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
3.有Al、CuO、Fe2O3组成的混合物共10.0g,放入200mL某浓度的硫酸溶液中,混合物完全溶解,当再加入280mL 1.0mol•L-1的NaOH溶液时,得到的沉淀最多.上述硫酸溶液的浓度为( )
| A. | 1.4 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.7 mol•L-1 | D. | 0.5mol•L-1 |
2.燃料电池是一类应用广泛的原电池.乙醇碱性燃料电池便是一种典型的代表.该电池负极
的电极反应为( )
的电极反应为( )
| A. | C2H5OH-12e-+12OH-═2CO2+9H2O | B. | O2+4H++4e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | C2H5OH+16OH--12e-═2CO32-+11H2O |
1.现有甲、乙两个图象,能同时满足两个图象的热化学方程式的是( )


| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
20.硫酸铜溶液可以解除白磷引起的中毒,有关反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法不正确的是( )
0 172301 172309 172315 172319 172325 172327 172331 172337 172339 172345 172351 172355 172357 172361 172367 172369 172375 172379 172381 172385 172387 172391 172393 172395 172396 172397 172399 172400 172401 172403 172405 172409 172411 172415 172417 172421 172427 172429 172435 172439 172441 172445 172451 172457 172459 172465 172469 172471 172477 172481 172487 172495 203614
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
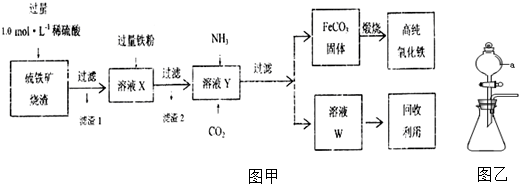
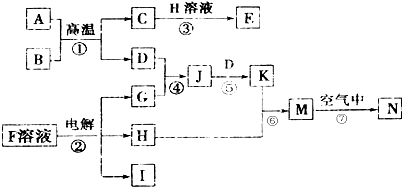
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.