题目内容
5.如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.B是一种具有磁性的氧化物,F是一种家庭常用的调味品,反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一(惰性电极).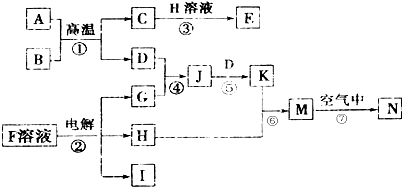
请回答下列问题
(1)B物质的名称为四氧化三铁_,H的电子式为
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.(2)上述①~⑦所示的反应中,属于氧化还原反应的序号为①②④⑤⑦;反应⑤的离子方程式为2Fe3++Fe=3Fe2+,⑦的实验现象为白色沉淀先变为灰绿色,再变为红褐色.
(3)H溶液中水的电离程度小于(填“大于”、“等于”或“小于”)相同浓度的E溶液中水的电离程度,原因是NaOH是一种强碱能抑制水的电离,而NaAlO2是一种强酸弱碱盐能促进水的电离.
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,若在两极共收集到标况下2.24L的气体,则此时溶液的pH=13(假设溶液的体积为1L且不考虑电解后溶液体积变化和气体溶解).
分析 反应①常被应用于野外焊接钢轨判断为铝热反应,A和B为Al和铁的氧化物,依据转化关系C、D为铁和氧化铝,B是一种具有磁性的氧化物,则B为Fe3O4,所以A为Al,F是一种家庭常用的调味品,②是工业上重要的反应之一,则F为NaCl,氯化钠溶液电解生成NaOH、H2和Cl2,C、D为铁和氧化铝,D、G反应生成J,J可以继续和D反应生成K,所以可推知D为Fe,G为Cl2,H为NaOH,J为FeCL3,K为FeCl2,所以I为H2,C为Al2O3,K+H=M,则M为Fe(OH)2,M在空气中氧化生成N为Fe(OH)3,C与H反应生成E为NaAlO2,综上所述各物质为:A为Al;B为Fe3O4;C为Al2O3;D为Fe;E为NaAlO2;F为NaCl;G为Cl2;H为NaOH;J为FeCL3;K为FeCl2;I为H2;M为Fe(OH)2;N为Fe(OH)3,据此答题.
解答 解:反应①常被应用于野外焊接钢轨判断为铝热反应,A和B为Al和铁的氧化物,依据转化关系C、D为铁和氧化铝,B是一种具有磁性的氧化物,则B为Fe3O4,所以A为Al,F是一种家庭常用的调味品,②是工业上重要的反应之一,则F为NaCl,氯化钠溶液电解生成NaOH、H2和Cl2,C、D为铁和氧化铝,D、G反应生成J,J可以继续和D反应生成K,所以可推知D为Fe,G为Cl2,H为NaOH,J为FeCL3,K为FeCl2,所以I为H2,C为Al2O3,K+H=M,则M为Fe(OH)2,M在空气中氧化生成N为Fe(OH)3,C与H反应生成E为NaAlO2,综上所述各物质为:A为Al;B为Fe3O4;C为Al2O3;D为Fe;E为NaAlO2;F为NaCl;G为Cl2;H为NaOH;J为FeCL3;K为FeCl2;I为H2;M为Fe(OH)2;N为Fe(OH)3,
(1)根据上面的分析可知,B物质的名称为四氧化三铁,H为NaOH,H的电子式为  ,N的化学式为Fe(OH)3,
,N的化学式为Fe(OH)3,
故答案为:四氧化三铁; ;Fe(OH)3;
;Fe(OH)3;
(2)上述①~⑦所示的反应中,反应①是铝热反应,反应②是电解饱和食盐水,反应④是氯气与铁生成氯化铁的反应,反应⑤是氯化铁与铁反应生成氯化亚铁的反应,反应⑦是氢氧化亚铁在空气中被氧化成氢氧化铁,都是属于氧化还原反应,故选①②④⑤⑦;反应⑤的离子方程式为2Fe3++Fe=3Fe2+,⑦的实验现象为白色沉淀先变为灰绿色,再变为红褐色,
故答案为:①②④⑤⑦;2Fe3++Fe=3Fe2+;白色沉淀先变为灰绿色,再变为红褐色;
(3)H为NaOH,溶液中氢氧根离子能抑制水的电离,E为NaAlO2,偏铝根发生水解,能促进水的电离,所以NaOH溶液中水的电离程度小于相同浓度的NaAlO2溶液中水的电离程度,
故答案为:小于;NaOH是一种强碱能抑制水的电离,而NaAlO2是一种强酸弱碱盐能促进水的电离;
(4)25℃时,以Pt为电极电解含有少量酚酞的NaCl的饱和溶液,电解方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,根据方程式可知,若在两极共收集到标况下2.24L即0.1mol的气体,生成0.1mol氢氧化钠,溶液的体积为1L,则此时c(OH-)=01mol/L,所以溶液的pH=13,
故答案为:13.
点评 本题考查了物质转化关系的应用,主要是铝热反应、电解饱和食盐水的反应特征是解题关键,题目难度中等.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案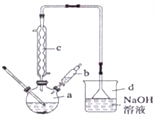 实验室制备溴苯的实验步骤如下:
实验室制备溴苯的实验步骤如下:步骤1:在a中加入苯和少量铁屑,将b中液溴慢慢加入到a中,充分反应;
步骤2:反应结束后,冷却至常温过滤反应液;
步骤3:滤液用水洗后再用10%的NaOH溶液洗,得粗溴苯;
步骤4:向粗溴苯中加入少量无水氯化钙,静置、过滤.
回答下列问题:
(1)仪器a中铁屑的作用是催化剂,a中发生的主要反应方程式是
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$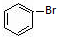 +HBr.
+HBr.(2)仪器c的作用是冷凝回流.
(3)步骤3中用水洗涤除去的物质是FeBr3,后用NaOH溶液洗涤除去的物质是Br2.
(4)步骤4得到的粗溴苯中还含有杂质苯和少量对二溴苯等,下表是有关物质的物理性质数据,为了得到纯净的溴苯,还必须要进行的实验名称是蒸馏.
| 苯 | 溴苯 | 对二溴苯 | |
| 密度/gcm-3 | 0.88 | 1.50 | 1.96 |
| 沸点/℃ | 80 | 156 | 220 |
| 水溶性 | 微溶 | 微溶 | 难溶 |
| A. | 氧化铁中滴加稀盐酸溶解:FeO+2H+═Fe2++H2O | |
| B. | 用稀硫酸、双氧水除去FeCl3溶液中的FeCl2杂质:Fe2++2H++H2O2═Fe3++2H2O | |
| C. | 硫酸铝溶液中滴加氨水制取氢氧化铝:Al3++3OH-═Al(OH)3↓ | |
| D. | 向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+2OH-+Ca2+═2H2O+CaCO3↓+CO32- |
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
| A. | 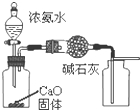 制取并收集干燥纯净的NH3 制取并收集干燥纯净的NH3 | B. |  除去NO2中的NO 除去NO2中的NO | ||
| C. |  检验装置的气密性 检验装置的气密性 | D. |  实验室洗涤胶头滴管的操作 实验室洗涤胶头滴管的操作 |
| A. | 5.6L | B. | 11.2L | C. | 2.24L | D. | 4.48L |