题目内容
3.有Al、CuO、Fe2O3组成的混合物共10.0g,放入200mL某浓度的硫酸溶液中,混合物完全溶解,当再加入280mL 1.0mol•L-1的NaOH溶液时,得到的沉淀最多.上述硫酸溶液的浓度为( )| A. | 1.4 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.7 mol•L-1 | D. | 0.5mol•L-1 |
分析 Al、CuO、Fe2O3组成的混合物共与硫酸反应生成氯硫酸铝、硫酸铜、硫酸铁,硫酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为硫酸钠,根据钠离子守恒有2n(Na2SO4)=n(NaOH),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),再根据c=$\frac{n}{V}$计算.
解答 解:Al、CuO、Fe2O3组成的混合物共与硫酸反应生成氯硫酸铝、硫酸铜、硫酸铁,硫酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为硫酸钠,
根据钠离子守恒有2n(Na2SO4)=n(NaOH),根据硫酸根守恒有:n(Na2SO4)=n(H2SO4),
则该硫酸的物质的量为:n(H2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.28L×1mol/L=0.14mol,
所以该硫酸的物质的量浓度为:c(H2SO4)=$\frac{0.14mol}{0.2L}$=0.7mol/L,
故选C.
点评 本题考查混合物反应的有关计算,题目难度中等,明确反应过程中氢氧化钠与硫酸的物质的量关系为解答关键,试题侧重学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.下列说法中正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 水泥、陶瓷、硅酸和水晶均为硅酸盐产品 | |
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| D. | 漂白粉、水玻璃、氨水和汽油均为混合物 |
11.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,11.2 L CO2中所含原子数为NA | |
| B. | 常温常压下,9 g H2O含有电子数为5 NA | |
| C. | 标准状况下,22.4 L SO3中所含分子数为NA | |
| D. | 22 g CO2中所含共价键数目为NA |
18.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加稀盐酸会产生白色沉淀 | 滴加稀盐酸产生白色沉淀的溶液中一定含有Ag+离子 |
| B | 硫酸铝溶液中滴加过量氨水制取氢氧化铝沉淀 | 硫酸铝溶液中滴加过量NaOH溶液最终得不到氢氧化铝沉淀 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加HI生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
8.设NA为阿伏伽德罗常数的值,下列叙述一定正确的是( )
| A. | 标准状况下,5.6L SO3含有的分子数为0.25NA | |
| B. | 标况下,0.1mol苯中含有C=C键数目为0.3NA | |
| C. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
15.下列说法正确的是( )
| A. | 摩尔是国际单位制规定的基本物理量 | |
| B. | 阿伏伽德罗常数被规定为12g 12C中所含的碳原子数 | |
| C. | 我们可以利用物质的量描述常见物质,如1mol 铅笔… | |
| D. | 物质的摩尔质量等于该物质的相对分子质量 |
12.对于反应N2+3H2?2NH3(正反应为放热反应),能使正反应速率和逆反应速率增大的因素有:①升高温度、②使用催化剂、③增大压强、④增加N2或和H2的浓度( )
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ①③④ |
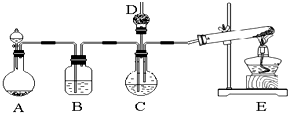
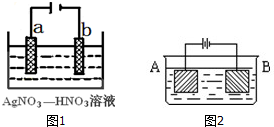 金属冶炼和处理常涉及电化学反应.
金属冶炼和处理常涉及电化学反应.