17.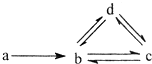 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaCl | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ② |
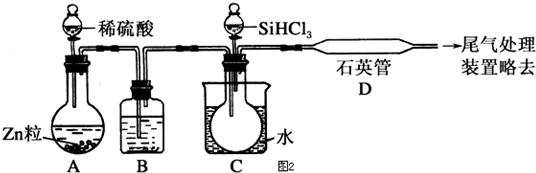
16.用50mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.该用品能否用铁质用品代替不能,原因是①铁的导热系数大,容易散热;②铁会与盐酸反应
(2)图示中用品填加后的装置叫量热器.
(3)烧杯间填满碎纸条的作用是保温,减少热量的散失.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”).
(5)如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,写出上述反应的热化学方程式NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值偏低(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.•℃),Q=C•m•△t则该反应的中和热为△H=-56.0kJ/mol.

(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.该用品能否用铁质用品代替不能,原因是①铁的导热系数大,容易散热;②铁会与盐酸反应
(2)图示中用品填加后的装置叫量热器.
(3)烧杯间填满碎纸条的作用是保温,减少热量的散失.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”).
(5)如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,写出上述反应的热化学方程式NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值偏低(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
15.下列各组物质中含氧原子的物质的量相同的是( )
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
14.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
| A. | 氯化铁 | B. | 碳酸氢钠 | C. | 硫酸铝 | D. | 高锰酸钾 |
11.下列分子结构:CO2、CH4、PCl5、Na2O2、MgF2,其中原子的最外层不能都满足8电子稳定结构的是CH4、PCl5,是离子化合物,且离子个数之比是2:1或1:2的是Na2O2、MgF2.
9.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下:
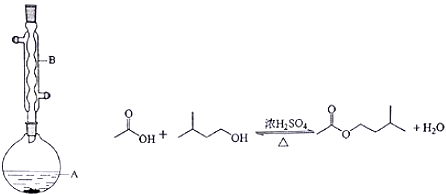
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的作用是冷凝回流
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸;第二次水洗的主要目的是:洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高异戊醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯
(6)在蒸馏操作中,仪器选择及安装都正确的是:b(填标号)

(7)本实验的产率是60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙 酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的作用是冷凝回流
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸;第二次水洗的主要目的是:洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高异戊醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯
(6)在蒸馏操作中,仪器选择及安装都正确的是:b(填标号)

(7)本实验的产率是60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.
8.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置(图A中的加热装置没有绘出)制取高纯度的苯甲酸甲酯,实验前他们从有关化学手册中查得有关物质的物理性质如表所示
实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
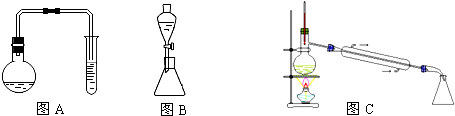
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
0 172261 172269 172275 172279 172285 172287 172291 172297 172299 172305 172311 172315 172317 172321 172327 172329 172335 172339 172341 172345 172347 172351 172353 172355 172356 172357 172359 172360 172361 172363 172365 172369 172371 172375 172377 172381 172387 172389 172395 172399 172401 172405 172411 172417 172419 172425 172429 172431 172437 172441 172447 172455 203614
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式
 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
 50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: