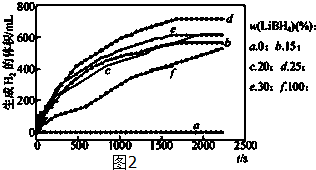
题目内容
9.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下: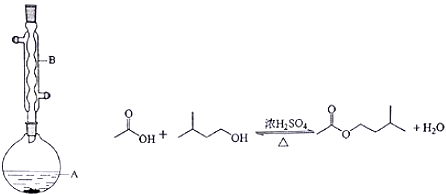
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙 酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的作用是冷凝回流
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸;第二次水洗的主要目的是:洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高异戊醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯
(6)在蒸馏操作中,仪器选择及安装都正确的是:b(填标号)

(7)本实验的产率是60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.
分析 (1)装置B是冷凝管,由于异戊醇、乙酸都是易挥发的物质,为使反应能充分进行,要用冷凝管冷凝回流;
(2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(4)根据反应物对增加一种反应物的浓度,可以使另一种反应物的转化率提高进行判断加入过量乙酸的目的;
(5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用;
(6)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;
(7)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率;
(8)若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,导致获得的乙酸异戊酯质量偏大.
解答 解:(1)装置B是冷凝管,由于异戊醇、乙酸都是易挥发的物质,为使反应能充分进行,要用冷凝管冷凝回流,
故答案为:冷凝回流;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,
故答案为:洗掉大部分硫酸和醋酸;洗掉碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,
故答案为:d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高提高异戊醇的转化率,
故答案为:提高异戊醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥,
故答案为:干燥乙酸异戊酯;
(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b,
故答案为:b;
(7)乙酸的物质的量为:n=$\frac{6.0g}{60g/mol}$=0.1mol,异戊醇的物质的量为:n=$\frac{4.4g}{88g/mol}$=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为:$\frac{3.9g}{130g/mol}$=0.03mol,所以实验中乙酸异戊酯的产率为:$\frac{0.03mol}{0.05mol}$×100%=60%,
故答案为:60%;
(8)在进行蒸馏操作时,若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高,
故答案为:高;会收集少量未反应的异戊醇.
点评 本题考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度较大,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$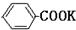 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→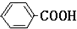 +KCl
+KCl实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,溶解 冷却、过滤, | 得到白色晶体和无色溶液 | -- |
| ② | 取少量滤液于试管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
| A. | 氯化铁 | B. | 碳酸氢钠 | C. | 硫酸铝 | D. | 高锰酸钾 |
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |
| A. |  根据图可判断可逆反应 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  图表示压强对可逆反应2A (g)+2B (g)?2AB3 (g)的影响,乙的压强大 | |
| C. |  图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| D. |  图④是N2与H2合成氨的能量变化曲线,可确定该反应1 molN2和4mol H2充分反应时放热一定小于92kJ |
 的是( )
的是( )| A. | CH3CH=CHCHCH2CH3 | B. | CH2=CHCHCH2CH3 | ||
| C. | CH≡CCHCH2CH3 | D. |  |