15.下列试验中,所选装置合理的是( )

| A. | 分离Na2CO3溶液和CH3COOC2H5,选③ | B. | 用CCl4提取碘水中的碘,选② | ||
| C. | 实验室中蒸馏水的制取,选④ | D. | 粗盐提纯,选②和③ |
14.下列说法正确的是( )
| A. | Na2O2可作为潜艇工作人员的供氧剂 | |
| B. | 电解熔融NaCl可制得Na单质 | |
| C. | Fe3O4通常作为油漆原料 | |
| D. | 可用Ba(OH)2溶液区别NaHCO3溶液和Na2CO3溶液 |
13.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 在常温常压下,11.2 L氯气所含的原子数目为NA | |
| B. | 32g氧气含的原子数目为NA | |
| C. | 5.6g铁与足量盐酸反应生成标准状况下H2的体积为2.24L | |
| D. | 2L 0.1mol•L-1 K2SO4溶液中离子总数约为1.4NA |
12.下列可以大量共存且形成无色溶液的一组离子应该是( )
| A. | Al3+、AlO2-、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
11.下列反应的离子方程式中正确的是( )
| A. | 碳酸氢钠溶液和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 碳酸钾溶液与稀硫酸反应:CO32-+H+═CO2↑+H2O | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 实验室制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2K++2Cl-+3O2↑ |
9.据法国《科学与未来》杂志报道,美国科学家最近在实验室中合成了与脱氧核糖核酸(DNA)分子结构相近的苏糖核酸分子.一些专家认为这种物质包含遗传信息,可能是第三种遗传分子.苏糖核酸简称TNA,是DNA和RNA的“近亲”.TNA中含有苏糖的结构单元.已知苏糖的结构简式为:CH2OHCHOHCHOHCHO,以下有关苏糖的说法中不正确的是( )
| A. | 苏糖能发生银镜反应 | |
| B. | 苏糖与甲酸甲酯含碳的质量分数相同 | |
| C. | 苏糖在一定条件下能发生取代反应 | |
| D. | 苏糖与葡萄糖互为同分异构体 |
8.对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基: +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
0 172191 172199 172205 172209 172215 172217 172221 172227 172229 172235 172241 172245 172247 172251 172257 172259 172265 172269 172271 172275 172277 172281 172283 172285 172286 172287 172289 172290 172291 172293 172295 172299 172301 172305 172307 172311 172317 172319 172325 172329 172331 172335 172341 172347 172349 172355 172359 172361 172367 172371 172377 172385 203614
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| C. | 甲苯$\stackrel{还原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$对氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{还原硝基}{→}$Y$\stackrel{氧化甲基}{→}$对氨基苯甲酸 |
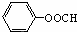 (写出结构简式).
(写出结构简式).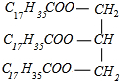 +3NaOH→C17H35COONa+
+3NaOH→C17H35COONa+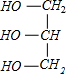 .
.