题目内容
12.下列可以大量共存且形成无色溶液的一组离子应该是( )| A. | Al3+、AlO2-、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生相互促进水解反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Al3+、AlO2-相互促进水解反应,不能大量共存,故A错误;
B.Fe3+为黄色,与无色不符,故B错误;
C.Ca2+、CO32-结合生成沉淀,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,且离子均为无色,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
3. 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:
为探究其成分,进行了以下探究实验.
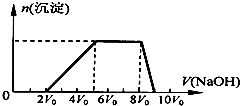
(1)探究一:甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定含有的阳离子是H+、NH4+、Al3+,其对应物质的量浓度之比为2:3:1,一定不存在的阴离子是CO32-、AlO2-;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2$_2^-$+2H2O.
(2)探究二:乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①原溶液中Cl-、Br-、I-的物质的量浓度之比为(最简整数比)10:15:3.
②当通入Cl2的体积达到11.2L时,溶液中发生的总反应的离子方程式可表示为:5Cl2+6I-+4Br-=10Cl-+3I2+2Br2.
 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定含有的阳离子是H+、NH4+、Al3+,其对应物质的量浓度之比为2:3:1,一定不存在的阴离子是CO32-、AlO2-;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2$_2^-$+2H2O.
(2)探究二:乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
②当通入Cl2的体积达到11.2L时,溶液中发生的总反应的离子方程式可表示为:5Cl2+6I-+4Br-=10Cl-+3I2+2Br2.
20.1.52g铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120mL (标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是( )
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | NO2和N2O4 的混合气体中,NO2的体积分数是80% | |
| D. | 该合金中铜与镁的物质的量之比是2:1 |
2.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、300 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{500℃、300MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:A12O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |


 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下: