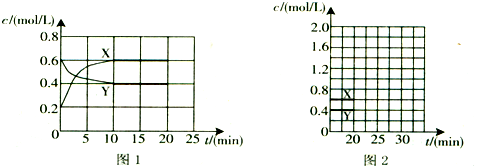
题目内容
15.下列试验中,所选装置合理的是( )
| A. | 分离Na2CO3溶液和CH3COOC2H5,选③ | B. | 用CCl4提取碘水中的碘,选② | ||
| C. | 实验室中蒸馏水的制取,选④ | D. | 粗盐提纯,选②和③ |
分析 A.Na2CO3溶液和CH3COOC2H5分层;
B.碘易溶于四氯化碳,不易溶于水;
C.蒸馏水的制取,选择蒸馏装置;
D.粗盐提纯,需溶解、过滤、蒸发操作.
解答 解:A.Na2CO3溶液和CH3COOC2H5分层,利用分液法分离,应选③,故A正确;
B.碘易溶于四氯化碳,不易溶于水,则利用萃取原理分离,应选③,故B错误;
C.蒸馏水的制取,选择蒸馏装置,则选④,故C正确;
D.粗盐提纯,需溶解、过滤操作,则选择①和②,故D错误;
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯方法及原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
5.合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.下图是以天然气为主要原料制备合成气,并用合成气生产甲醇和二甲醚(CH3OCH3)及炼铁的一种工艺流程:
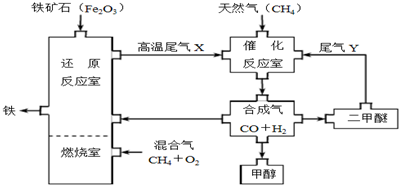
(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
则T1=250,P1=5.

(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
| 实验编号 | n(H 2)/n(CO) | T/℃ | P/MPa |
| i | m1 | 250 | 1 |
| ii | 3 | T1 | 5 |
| iii | m2 | 350 | P1 |
20.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在298k温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
①该温度下,此反应的平衡常数K=$\frac{9}{25}$;
②若反应在398K进行,某时刻测得n(CO)=0.5mol n(H2O)=1.0mol,n(CO2)=1.0mol n(H2)=1.2mol则此时V(正)<V(逆)(填“>”、“<”或“=”).
(4)CaS在一定条件下经原子利用率100%的高温反应生成CaSO4,该反应的化学方程式为CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,对二甲苯的结构产简式为: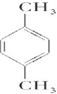 ,产物的结构简式为
,产物的结构简式为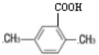 .
.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在298k温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②若反应在398K进行,某时刻测得n(CO)=0.5mol n(H2O)=1.0mol,n(CO2)=1.0mol n(H2)=1.2mol则此时V(正)<V(逆)(填“>”、“<”或“=”).
(4)CaS在一定条件下经原子利用率100%的高温反应生成CaSO4,该反应的化学方程式为CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,对二甲苯的结构产简式为:
 ,产物的结构简式为
,产物的结构简式为 .
.
7.下列实验不能达到预期目的是( )
| A. | 用饱和食盐水除去Cl2中少量的HCl | |
| B. | 往溴水中通入SO2,可检验SO2的还原性和漂白性 | |
| C. | 往溶液加入盐酸,产生无色无味且能使澄清石灰水浑浊的气体,该气体一定是CO2 | |
| D. | 用硝酸酸化的氯化钡溶液检验某溶液中是否含有SO42- |
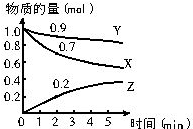
5.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是( )
| A. | Y的价层电子排布式为3s23p5 | |
| B. | 稳定性:Y的氢化物>Z的氢化物 | |
| C. | 第一电离能:Y<Z | |
| D. | X、Y两元素形成的化合物为离子化合物 |
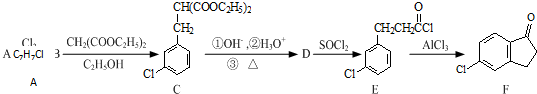
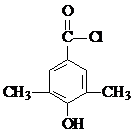 或
或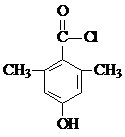 (任写一种).
(任写一种). .
.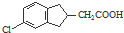 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下:
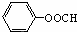 (写出结构简式).
(写出结构简式).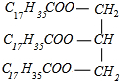 +3NaOH→C17H35COONa+
+3NaOH→C17H35COONa+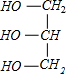 .
.