1.甲基、羟基、羧基和苯基四种官能团,两两结合形成的化合物水溶液的pH小于7的有( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
20.下列反应中,液体植物油不能发生的反应是( )
| A. | 加成反应 | B. | 氧化反应 | C. | 水解反应 | D. | 缩聚反应 |
18.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一,回答下列问题:
(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
①x=0.14,250℃时该反应的平衡常数K=46.3.
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
17. 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
CO(g)+2H2(g)?CH3OH (g)
(1)在容积固定为2L的密闭容器内充入1mol CO和2mol H2,加入 催化剂后在250℃开始反应,CO的平衡转化率与温度、压强的关系如图所示.
容器中M、N两点气体的物质的量之比为5:4.
M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ.
(2)通过压力计监测上述容器内压强的变化如下:
则从反应开始到20min时,以CO表示的平均反应速率为0.0125mol/(L.min),该温度下平衡常数K=4.
(3)下列描述中能说明上述反应已达平衡状态的是BC.
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300mL NaCl溶液,正极反应式为O2+4 H++4 e-=2 H2O.在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为0.005mol.
0 172186 172194 172200 172204 172210 172212 172216 172222 172224 172230 172236 172240 172242 172246 172252 172254 172260 172264 172266 172270 172272 172276 172278 172280 172281 172282 172284 172285 172286 172288 172290 172294 172296 172300 172302 172306 172312 172314 172320 172324 172326 172330 172336 172342 172344 172350 172354 172356 172362 172366 172372 172380 203614
 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:CO(g)+2H2(g)?CH3OH (g)
(1)在容积固定为2L的密闭容器内充入1mol CO和2mol H2,加入 催化剂后在250℃开始反应,CO的平衡转化率与温度、压强的关系如图所示.
容器中M、N两点气体的物质的量之比为5:4.
M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ.
(2)通过压力计监测上述容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡状态的是BC.
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300mL NaCl溶液,正极反应式为O2+4 H++4 e-=2 H2O.在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为0.005mol.
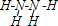 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.