题目内容
20.下列反应中,液体植物油不能发生的反应是( )| A. | 加成反应 | B. | 氧化反应 | C. | 水解反应 | D. | 缩聚反应 |
分析 植物油含碳碳双键和酯基,据此解题.
解答 解:A.植物油含碳碳双键,能发生加成反应,故A错误;
B.植物油含碳碳双键,易被氧化,故B错误;
C.植物油含酯基,易发生水解反应,故C错误;
D.植物油不能发生缩聚反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质的关系为解答的关键,侧重烯烃、醛、卤代烃等有机物性质的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.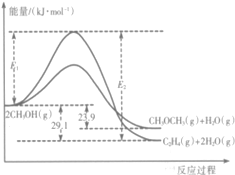 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ/mol.则乙烯气相直接水合反应C2H4(g)+H2O(g)═C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ/mol.则乙烯气相直接水合反应C2H4(g)+H2O(g)═C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 编号 起始投料/mol | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
8.已知某温度下反应2A(s)+3B(g)?3C(g)+D(s)△H<0的平衡常数为64.此温度下,在一个容积为2L的密闭容器中加入A、B、C、D各2.0mol,10min后反应达到平衡.下列说法正确的是( )
| A. | 该反应的平衡常数表达式为k=$\frac{{c}^{3}(C)•c(D)}{{c}^{2}(A)•{c}^{3}(B)}$ | |
| B. | 升高温度,该反应的平衡常数增大 | |
| C. | 从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L•min) | |
| D. | B的平衡转化率为60% |
15.以甲烷为初始原料制取氢气,是一项比较成熟的技术,下面是制取氢气的流程图如图1,根据信息回答下列问题:
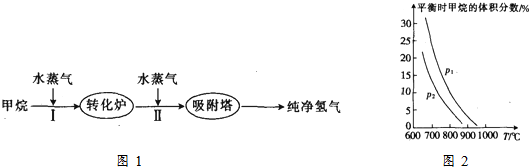
(1)阶段I发生的反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
①写出该反应的平衡常数表达式$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$;
②已知在“水碳比”$\frac{c({H}_{2}O)}{c(C{H}_{4})}$=3时,测得温度(T )和压强(p)对上述反应的影响如图2所示.则升高温度,该反应的平衡常数K增大(填“增大”、“减小”或“不变”),据图可知P1>P2.(填“>”、“<”或“=”)
(2)阶段Ⅱ发生的反应为CO(g)+H2O(g)?CO2(g)+H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如表所示(表中t1<t2):
①保持T1温度不变,若向原容器中通入 0.60mol CO和1.20mol H2O(g),则达到平衡后n(CO2)=0.4mol.
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20mol H2O(g),则下列说法正确的是ab.
a、CO的转化率将增大 b、H2O(g)的体积分数将增大
c、气体的密度将不变 d、化学平衡常数将增大.

(1)阶段I发生的反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
①写出该反应的平衡常数表达式$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$;
②已知在“水碳比”$\frac{c({H}_{2}O)}{c(C{H}_{4})}$=3时,测得温度(T )和压强(p)对上述反应的影响如图2所示.则升高温度,该反应的平衡常数K增大(填“增大”、“减小”或“不变”),据图可知P1>P2.(填“>”、“<”或“=”)
(2)阶段Ⅱ发生的反应为CO(g)+H2O(g)?CO2(g)+H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如表所示(表中t1<t2):
| 反应时间(min) | n(CO)(mol) | N(H2O)(mol) |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20mol H2O(g),则下列说法正确的是ab.
a、CO的转化率将增大 b、H2O(g)的体积分数将增大
c、气体的密度将不变 d、化学平衡常数将增大.
9.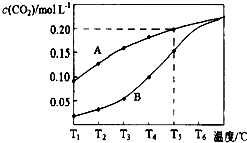 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
(1)该反应正反应为吸热反应(填吸或放),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为0.2.
(2)如果该反应的平衡常数K值变大,该反应bc(选填编号).
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:随着温度升高,反应速率加快,达到平衡所需要的时间变短.
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入0.5molN2,则最后平衡时容器中的CaCO3的质量为10g.
(5)已知苯酚和碳酸的电离平衡常数如图所示请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式C6H5O-+CO2+H2O→C6H5OH+HCO3-,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据二氧化碳与水结合生成碳酸,且碳酸酸性比苯酚酸性强,故能生成苯酚.碳酸的电离分两步:第一步:H2CO3?H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-?H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡.
 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:(1)该反应正反应为吸热反应(填吸或放),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为0.2.
(2)如果该反应的平衡常数K值变大,该反应bc(选填编号).
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:随着温度升高,反应速率加快,达到平衡所需要的时间变短.
| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
(5)已知苯酚和碳酸的电离平衡常数如图所示请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式C6H5O-+CO2+H2O→C6H5OH+HCO3-,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据二氧化碳与水结合生成碳酸,且碳酸酸性比苯酚酸性强,故能生成苯酚.碳酸的电离分两步:第一步:H2CO3?H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-?H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡.
10.我省的海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用资源和保护环境是我省可持续发展的重要保证.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据如表数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图1所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图2所示.请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,氧气氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据如表数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图2所示.请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,氧气氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).

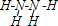 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.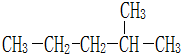 :2-甲基戊烷;
:2-甲基戊烷;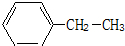 乙苯
乙苯 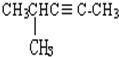 4-甲基-2-戊炔.
4-甲基-2-戊炔.