7.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 生产粗硅 | B. | 海水提镁 | C. | 电解冶铝 | D. | 生产硫酸 |
6.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法不利于该目标实现的是( )
| A. | 推广使用无磷洗涤剂 | |
| B. | 用O3替代Cl2作饮用水消毒剂 | |
| C. | 用工业污水直接灌溉农田 | |
| D. | 含Cr3+的废水用适量石灰处理后排放 |
5.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3各0.01mol的混和溶液中,加入0.01mol的铁粉,经充分搅拌后,产生的变化是( )
| A. | 铁溶解,析出0.01molZn | |
| B. | 铁溶解,析出铜,且溶液中不含有Fe3+ | |
| C. | 铁溶解,析出0.01molCu | |
| D. | 铁溶解,溶液中金属阳离子只剩Fe2+和Zn2+ |
4.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断错误的是( )
| A. | 反应的氧化剂是ClO- | |
| B. | 消耗l mol还原剂,转移电子6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为 3:2 | |
| D. | 反应后溶液中H+的物质的量变大 |
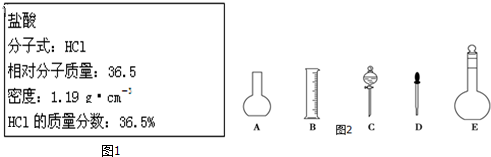
1.下列仪器常用于物质分离的是( )


| A. | ①③⑤ | B. | ①②⑥ | C. | ②④⑤ | D. | ②③⑤ |
20.还原性的无水草酸是无色无臭的透明结晶或白色粉末.草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳.
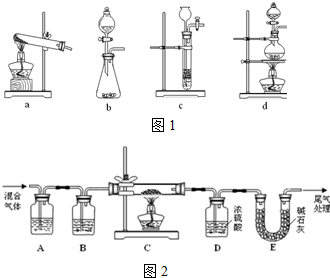
(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.
0 172166 172174 172180 172184 172190 172192 172196 172202 172204 172210 172216 172220 172222 172226 172232 172234 172240 172244 172246 172250 172252 172256 172258 172260 172261 172262 172264 172265 172266 172268 172270 172274 172276 172280 172282 172286 172292 172294 172300 172304 172306 172310 172316 172322 172324 172330 172334 172336 172342 172346 172352 172360 203614

(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化剂对反应速率的影响 | 0.1 | |||
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.