题目内容
4.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断错误的是( )| A. | 反应的氧化剂是ClO- | |
| B. | 消耗l mol还原剂,转移电子6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为 3:2 | |
| D. | 反应后溶液中H+的物质的量变大 |
分析 c(NH4+)随反应进行逐渐减小,NH4+应是反应物,N元素化合价发生升高,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,
A.Cl元素的化合价降低,则反应的氧化剂是ClO-,故A正确;
B.N元素的化合价由-3价升高为0,NH4+为还原剂,则消耗1mol还原剂,转移电子3mol,故B错误;
C.由反应可知,氧化剂与还原剂的物质的量之比为3:2,故C正确;
D.反应生成H+,则物质的量变大,故D正确.
故选B.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
14.下列实验操作中不正确的是( )
| A. | 给烧杯中的液体加热时,不需垫石棉网 | |
| B. | 用药匙或者纸槽把粉末状药品送人试管的底部 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 给试管中的液体加热时管口不要对着白己和别人,以免液体暴沸伤人 |
15.下表是几种电解质的电离常数(25℃)电解质的强弱判断正确的是( )
| 电解质 | a.HF | b.HNO2 | c.HCN | d.NH3.H2O | e.H2S |
| 电离平衡常数 | 7.2×10-4 | 4.6×10-4 | 4.9×10-10 | 1.8×10-5 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | e最弱 | B. | b最强 | ||
| C. | 由强到弱的顺序为a>b>d>e>c | D. | 无法确定 |
12.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向稀的苯酚水溶液中滴加饱 和溴水 | 生成白色沉淀 | 产物三溴苯酚溶于水 |
| C | 向含I-的无色溶液中滴加少量铁盐溶液,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Fe3+>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
9.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.

 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: -CH=CHCOOCH2CH2-
-CH=CHCOOCH2CH2-
 CH=CH2+2ROH+2CO+O2CH3
CH=CH2+2ROH+2CO+O2CH3  CH=CHCOOR+2H2O
CH=CHCOOR+2H2O 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.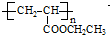 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.