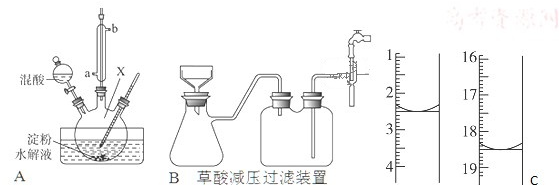
4.CoCl2•6H2O是一种饲料营养强化剂,一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、•Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表.
(1)盐酸的作用是溶解矿石,提供酸性环境,Na2SO3的作用是(文字描述)将Fe3+、Co3+还原.
(2)NaClO3加入浸出液后生成NaCl,写出反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)加Na2CO3调pH至5.2的目的是为完全沉淀Fe3+、Al3+.
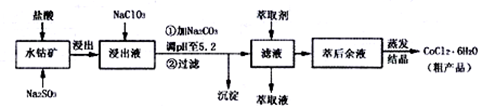
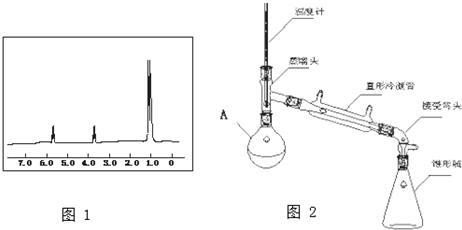
(4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+,其使用的适宜pH范围是C.A.1.0~2.0 B.2.0~2.5 C.3.0~3.5 D 4.0~4.5
(5)取部分加入萃取剂后的混合液,在实验室按流程图获得粗产品.
①使用分液漏斗前要检漏,是检查玻璃塞、旋塞芯是否漏水,若发现其中一处漏水,必要的操作或做法是若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好.(只写出其中一种漏水对应的操作或做法)
②在蒸发过程中为防止产生杂质或脱水,当较多晶体析出时,改为抽滤得到晶体.
写出抽滤装置(如图2)中指定仪器的名称:A安全瓶,B抽气泵.
下列抽滤操作或说法正确的是ABE
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状或颗粒太小的沉淀
用少量蒸馏水洗涤晶体,判断晶体是否洗净的具体操作是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3加入浸出液后生成NaCl,写出反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)加Na2CO3调pH至5.2的目的是为完全沉淀Fe3+、Al3+.
(4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+,其使用的适宜pH范围是C.A.1.0~2.0 B.2.0~2.5 C.3.0~3.5 D 4.0~4.5
(5)取部分加入萃取剂后的混合液,在实验室按流程图获得粗产品.
①使用分液漏斗前要检漏,是检查玻璃塞、旋塞芯是否漏水,若发现其中一处漏水,必要的操作或做法是若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好.(只写出其中一种漏水对应的操作或做法)
②在蒸发过程中为防止产生杂质或脱水,当较多晶体析出时,改为抽滤得到晶体.
写出抽滤装置(如图2)中指定仪器的名称:A安全瓶,B抽气泵.
下列抽滤操作或说法正确的是ABE
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀

C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状或颗粒太小的沉淀
用少量蒸馏水洗涤晶体,判断晶体是否洗净的具体操作是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.
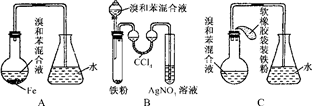
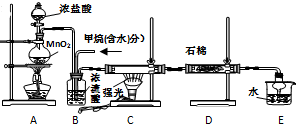
1.某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
请回答下列问题:
(1)写出仪器A的名称:球形冷凝管;
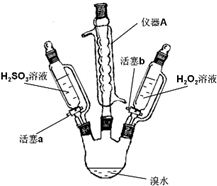
(2)实验记录如下:
(3)步骤Ⅱ中,开始时颜色无明显变化的原因是(写出一条即)步骤1的H2SO3有过量,H2O2先和H2SO3反应;写出步骤Ⅱ中反应的离子方程式H2SO3+H2O2=2H++SO42-+H2O、2H++2Br-+H2O2=Br2+2H2O;
(4)实验室常用Cl2通入NaBr溶液中制得单质溴,工业上常用电解饱和食盐水制备Cl2,装置如图所示,利用该装置,工业上除得到氯气外,还可以得到NaOH,H2(填化学式);装置中的离子交换膜Na+可以通过而OH-不能通过,的目的是避免Cl2与NaOH反应生成NaClO,影响NaOH的产量和纯度.

请回答下列问题:
(1)写出仪器A的名称:球形冷凝管;

(2)实验记录如下:
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 烧瓶内溶液由橙黄色变为无色 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
(4)实验室常用Cl2通入NaBr溶液中制得单质溴,工业上常用电解饱和食盐水制备Cl2,装置如图所示,利用该装置,工业上除得到氯气外,还可以得到NaOH,H2(填化学式);装置中的离子交换膜Na+可以通过而OH-不能通过,的目的是避免Cl2与NaOH反应生成NaClO,影响NaOH的产量和纯度.

19.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量铝)生产碱式硫酸铁的工
艺流程如下:
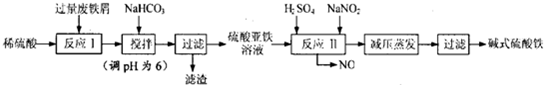
请回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成吸附能力很强的胶体.
(2)已知,常温下部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表.假设沉淀完全时溶液中金属离子的浓度为1×10-5 mol•L-1,估算Ksp[Fe(OH)2]=1×10-15.生产碱式硫酸铁的过程中,加入少量NaHCO3
调溶液pH=6的目的是调节溶液的pH促进Al3+水解转化为沉淀完全除去.
(3)反应II的离子方程式是Fe2++NO2-+2H+═Fe3++NO↑+H2O,在实际生产中,常同时通入O2以减少反应II中NaNO2的用量.若实际生产中需要节约1.38t的NaNO2用量,则应通入标准状况下的O2112m3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO${\;}_{3}^{-}$.某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有 SO${\;}_{4}^{2-}$,可供选择的试剂如下:
A.新制氯水 B.0.l mol/L KSCN溶液 C.10%NaOH溶液
D.20%HNO3溶液 E.0.05mol/L酸性KMnO4溶液 F.0.l mol/L BaCl2溶液
请你帮助该同学完成实验,将相关项目填入下表:
0 172152 172160 172166 172170 172176 172178 172182 172188 172190 172196 172202 172206 172208 172212 172218 172220 172226 172230 172232 172236 172238 172242 172244 172246 172247 172248 172250 172251 172252 172254 172256 172260 172262 172266 172268 172272 172278 172280 172286 172290 172292 172296 172302 172308 172310 172316 172320 172322 172328 172332 172338 172346 203614
艺流程如下:

请回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成吸附能力很强的胶体.
(2)已知,常温下部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表.假设沉淀完全时溶液中金属离子的浓度为1×10-5 mol•L-1,估算Ksp[Fe(OH)2]=1×10-15.生产碱式硫酸铁的过程中,加入少量NaHCO3
调溶液pH=6的目的是调节溶液的pH促进Al3+水解转化为沉淀完全除去.
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO${\;}_{3}^{-}$.某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有 SO${\;}_{4}^{2-}$,可供选择的试剂如下:
A.新制氯水 B.0.l mol/L KSCN溶液 C.10%NaOH溶液
D.20%HNO3溶液 E.0.05mol/L酸性KMnO4溶液 F.0.l mol/L BaCl2溶液
请你帮助该同学完成实验,将相关项目填入下表:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
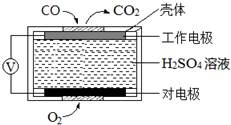 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.
 .
.
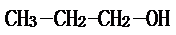 ;2-丙醇:
;2-丙醇: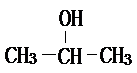 .
.
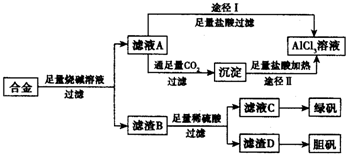 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题: