��Ŀ����
7��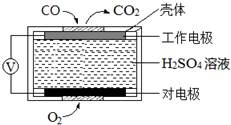 ̼��������������������Ĵ�������������������о����ȵ����⣮
̼��������������������Ĵ�������������������о����ȵ����⣮��1����������β���е�NO��CO�������ڼ���PM2.5���ŷţ���֪������Ϣ��
I��

II��N2��g��+O2��g��?2NO��g����H1
2CO��g��+O2��g��?2CO2��g����H2=-565kJ•mol-1
�١�H1=+183kJ•mol-1��
���ڴ���������NO��COת��Ϊ�����壬д����Ӧ���Ȼ�ѧ����ʽ2NO��g��+2CO��g��=2CO2��g��+N2��g����H=-748kJ/mol
��2���绯ѧ�������������ⶨ����β��������CO�������Ĺ���ԭ����ͼ��ʾ�������缫�ķ�ӦʽΪCO-2e-+H2O=CO2+2H+
��3����ҵ�Ͽ�����NaOH��Һ��ˮ���չ�����SO2���ֱ�����NaHSO3��NH4HSO3����ˮ��Һ�������ԣ���ͬ�����£�ͬŨ�ȵ�������ʽ�ε�ˮ��Һ��c��SO32-����С����NH4HSO3�������ֺͻ�ѧ�������ԭ��HSO3-?H++SO32-����NH4+ˮ�⣺NH4++H2O?NH3��H2O+H+��ʹ��Һ��c��H+����������HSO3-���룬��Һ��SO32-Ũ�ȼ�С
��4��T��ʱ���� 2L�����ܱ������У�����Fe3O4��CO��1.0mol��10min��Ӧ�ﵽƽ��ʱ��������CO2��Ũ����0.4mol/L��
����֤���÷�Ӧ�ﵽ��ѧƽ�����c��ѡ����ĸ����
a��������ѹǿ���ٱ仯
b��������CO��CO2���ʵ�����Ϊ1��1
c��������������������ٱ仯
d������CO2������������CO���������
��l0min�ڣ���Ӧ��ƽ����Ӧ����v ��CO2��=0.04mol/��L��min����
��T��ʱ���÷�Ӧ��ƽ�ⳣ��K=256��
���� ��1���ٷ�Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�
����֪��N2��g��+O2��g��=2NO��g����H1����
2CO��g��+O2��g��=2CO2��g����H2=-565KJ•mol-1����
���ݸ�˹���ɣ���-�ٿɵã�2NO��g��+2NO��g��=2CO2��g��+N2��g����
��2����ͼ��֪�������缫����CO�������ɶ�����̼����Ҫ��ˮ�μӷ�Ӧ�����غ��غ��֪�����������ɣ�
��3��HSO3-����õ�H+��SO32-����NH4+ˮ��ʹ��Һ������ǿ������HSO3-���룻
��4��T��ʱ���� 2L�����ܱ������У�����Fe3O4��CO��1.0mol��10min��Ӧ�ﵽƽ��ʱ��������CO2��Ũ����0.4mol/L����
Fe3O4��s��+4CO��g��?3Fe��s��+4CO2��g��
��ʼ����mol/L����0.5 0
�仯����mol/L����0.4 0.4
ƽ������mol/L����0.1 0.4
��a��������ѹǿʼ�ձ��ֲ��䣻
b��ƽ��ʱ������CO��CO2���ʵ���֮����CO��ת�����йأ�
c���淴Ӧ���У��������������������������������������ٱ仯˵������ƽ�⣻
d������CO2������������CO�����ʾ�Ϊ����Ӧ���ʣ�����ʼ����ȣ�
�ڸ���v=$\frac{��c}{��t}$����v ��CO2����
��ƽ�ⳣ��K=$\frac{{c}^{4}��C{O}_{2}��}{{c}^{4}��CO��}$������Ũ�ȼ��㣮
��� �⣺��1���ٷ�Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ����H1=945kJ/mol+498kJ/mol-2��630kJ/mol=+183kJ/mol��
�ʴ�Ϊ��+183kJ/mol��
����֪��N2��g��+O2��g��=2NO��g����H1=+183kJ/mol ��
2CO��g��+O2��g��=2CO2��g����H2=-565KJ•mol-1 ��
���ݸ�˹���ɣ���-�ٿɵã�2NO��g��+2CO��g��=2CO2��g��+N2��g����H=-748kJ/mol��
�ʴ�Ϊ��2NO��g��+2CO��g��=2CO2��g��+N2��g����H=-748kJ/mol��
��2����ͼ��֪�������缫����CO�������ɶ�����̼����Ҫ��ˮ�μӷ�Ӧ�����غ��غ��֪�����������ɣ��缫��ӦʽΪ��CO-2e-+H2O=CO2+2H+��
�ʴ�Ϊ��CO-2e-+H2O=CO2+2H+��
��3��HSO3-?H++SO32-����NH4+ˮ�⣺NH4++H2O?NH3��H2O+H+��ʹ��Һ��c��H+����������HSO3-���룬��NH4HSO3��Һ��SO32-Ũ�Ƚ�С��
�ʴ�Ϊ��NH4HSO3��HSO3-?H++SO32-����NH4+ˮ�⣺NH4++H2O?NH3��H2O+H+��ʹ��Һ��c��H+����������HSO3-���룬��Һ��SO32-Ũ�ȼ�С��
��4��T��ʱ���� 2L�����ܱ������У�����Fe3O4��CO��1.0mol��10min��Ӧ�ﵽƽ��ʱ��������CO2��Ũ����0.4mol/L����
Fe3O4��s��+4CO��g��?3Fe��s��+4CO2��g��
��ʼ����mol/L����0.5 0
�仯����mol/L����0.4 0.4
ƽ������mol/L����0.1 0.4
��a����Ӧǰ����������ʵ������䣬���º�����������ѹǿʼ�ձ��ֲ��䣬��a����
b��ƽ��ʱ������CO��CO2���ʵ���֮����CO��ת�����йأ�ƽ��ʱ��һ��Ϊ1��1����b����
c���淴Ӧ���У��������������������������������������ٱ仯˵������ƽ�⣬��c��ȷ��
d������CO2������������CO�����ʾ�Ϊ����Ӧ���ʣ�����ʼ����ȣ�Ӧ������CO2������������CO���������ʱ��Ӧ����ƽ�⣬��d����
��ѡ��c��
��v ��CO2��=$\frac{0.4mol/L}{10min}$=0.04mol/��L��min�����ʴ�Ϊ��0.04mol/��L��min����
��ƽ�ⳣ��K=$\frac{{c}^{4}��C{O}_{2}��}{{c}^{4}��CO��}$=$\frac{0��{4}^{4}}{0��{1}^{4}}$=256���ʴ�Ϊ��256��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ�ȼ��㡢�Ȼ�ѧ����ʽ��д������ˮ�⡢���ԭ���ȣ��Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�

| A�� | �����£�Ũ�Ⱦ�Ϊ0.2mol•L-1��NaHCO3��Na2CO3��Һ�У������ڵ���ƽ���ˮ��ƽ�⣬�ֱ����NaOH����ָ���ԭ�����¶ȣ�c��CO32- �������� | |
| B�� | ��֪���ᣨHA�������Աȼ��ᣨHB�����������ʵ���Ũ�Ⱦ�Ϊ0.1 mol•L-1��NaA��NaB�����Һ�У�c��Na+����c��B-����c��A-����c�� OH-����c��HA����c��HB����c��H+�� | |
| C�� | pH��ͬ��CH3COONa��Һ��C6H5ONa��Һ��Na2CO3��Һ��NaOH��Һ����Ũ�ȣ�c��CH3COONa����c��C6H5ONa����c�� Na2CO3����c��NaOH�� | |
| D�� | һ���¶��£�pH��ͬ����Һ����ˮ���������c��H+����ͬ |
I����֪��ӦFe2O3��s��+CO��g��?Fe��s��+CO2��g����H=-23.5kJ•mol-1���÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮
��1��CO��ƽ��ת����=60%
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ��d��
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
��¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO��g��+2H2��g��?CH3OH��g���������ͼʾ�ش��������⣺
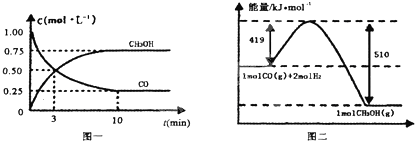
��3���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��=0.15mol/��L•min����
��4����֪������ȼ����286kJ/mol����д���״����岻���ȼ�յ��Ȼ�ѧ����ʽCH3OH��g��+O2��g��=2H2O��l��+CO��g����H=-481kJ/mol��
��5�������¶Ⱥ�������ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
A��c1=c2B.2Q1=Q3C.2��1=��3D����1+��2=1E���÷�Ӧ������1mol CH3OH����ų���Q1+Q2��kJ����
���Լ���Ϊȼ�ϵ����͵�أ���ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ���ش��������⣺

��6��B���ϵĵ缫��ӦʽΪCH4-8e-+4O2-=CO2+2H2O��
��7�����ø�ȼ�ϵ������Դ����ʯī���缫���100mL 1mol/L������ͭ��Һ���������ռ���������������ʱ�����������ĵļ�������Ϊ1.12L������£���
| A�� | 0.1 mol•L-l | B�� | 0.2 mol•L-l | C�� | 0.3 mol•L-l | D�� | 0.4 mol•L-l |
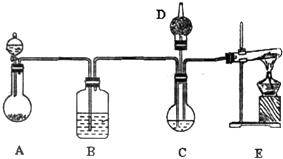 ����̼����й㷺��Ӧ��ǰ��������ͼ��ʾװ�ã���ŨCaCl2��Һ��ͨ��NH3��CO2���Ƶ�����̼��ƣ�D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
����̼����й㷺��Ӧ��ǰ��������ͼ��ʾװ�ã���ŨCaCl2��Һ��ͨ��NH3��CO2���Ƶ�����̼��ƣ�D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��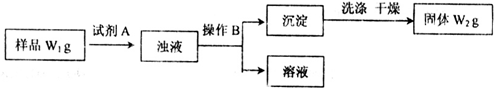
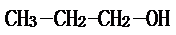 ��2-������
��2-������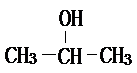 ��
��