17.下列分类标准正确的是( )
| A. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:有没有单质参加或生成) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:有没有丁达尔效应) | |
| C. | 化学反应分为:化合反应、分解反应、置换反应、复分解反应(标准:按反应物和生成物的类别以及反应前后物质种类的多少) | |
| D. | 无色的溶液:CO32-、SO42-、Cu2+、NH4+ |
16.能正确表示下列反应的离子方程式是( )
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 硫酸铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
15.下列反应中必须加入还原剂才能进行的是( )
| A. | CuO→Cu | B. | KI→I2 | C. | H2→H2O | D. | HCl→Cl2 |
11.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,再移走酒精灯停止加热 | |
| B. | 蒸馏实验中,温度计的水银球应插入液态混合物中 | |
| C. | 开始蒸馏时,应该先开冷凝水,再点燃酒精灯;蒸馏完毕,应先撤酒精灯再关冷凝水 | |
| D. | 萃取操作时,应选择合适的有机萃取剂,且萃取剂的密度必须比水大 |
9.对甲苯丙烯酸的结构如图  下列说法错误的是( )
下列说法错误的是( )
0 172143 172151 172157 172161 172167 172169 172173 172179 172181 172187 172193 172197 172199 172203 172209 172211 172217 172221 172223 172227 172229 172233 172235 172237 172238 172239 172241 172242 172243 172245 172247 172251 172253 172257 172259 172263 172269 172271 172277 172281 172283 172287 172293 172299 172301 172307 172311 172313 172319 172323 172329 172337 203614
 下列说法错误的是( )
下列说法错误的是( )| A. | 对甲苯丙烯酸的分子式为C10H10O2 | |
| B. | 对甲苯丙烯酸能发生的反应类型有加成、取代、氧化 | |
| C. | 对甲苯丙烯酸中所有碳原子有可能共平面 | |
| D. | 对甲苯丙烯酸能使酸性高锰酸钾溶液和溴水褪色,其原理相同 |
 .
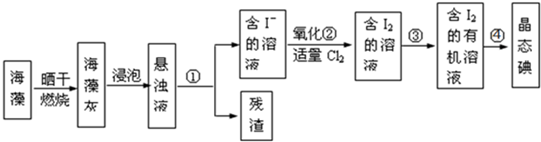
.
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. .
.