题目内容
14.实验室需要250mL 2mol/L的稀H2SO4,现用18.4mol/L的浓H2SO4来配制可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙.(1)上述仪器中在配制稀H2SO4时,还缺少的仪器是250 mL容量瓶.
(2)经计算,需量取浓H2SO4的体积为27.2mL.
量取浓硫酸时应选用②(选填①10mL、②50mL、③100mL三种规格)的量筒.
(3)配制溶液过程中下列操作能引起所配溶液浓度偏高是C.
A量取浓硫酸时俯视读数
B量取浓硫酸后的量筒未洗涤,内壁残留的溶液未转移到烧杯中
C未冷却到室温就定容
D 定容时仰视读数
E 定容摇匀后发现液面低于刻度线,继续用胶头滴管加水至刻度线
(4)若取40mL所配的稀H2SO4,用2mol/L NaOH与之恰好反应完全,配制所需的NaOH溶液需用托盘天平称取NaOH固体8.0克,可得Na2SO4的物质的量为0.08mol.
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据H2SO4~2NaOH~Na2SO4,据此计算需要氢氧化钠的物质的量、质量,生成硫酸钠的物质的量.
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、250ml容量瓶,还缺少的仪器为:250ml容量瓶;
故答案为:250 mL容量瓶;
(2)设需要浓硫酸溶液的体积为V,根据溶液稀释前后溶质的物质的量不变得:2mol•L-1×250ml=V×18.4mol/L,解得V=27.2mL;应选择50ml量筒;
故答案为:27.2mL; ②;
(3)A量取浓硫酸时俯视读数,导致量取的浓硫酸的体积偏小,硫酸的物质的量偏小,溶液浓度偏低,故A不选;
B量取浓硫酸后的量筒未洗涤,内壁残留的溶液未转移到烧杯中,实验操作正确,溶液浓度准确,故B不选;
C未冷却到室温就定容,冷却后,溶液体积偏小,溶液浓度偏高,故C选;
D 定容时仰视读数,导致溶液体积偏大,溶液浓度偏低,故D不选;
E 定容摇匀后发现液面低于刻度线,继续用胶头滴管加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故E不选;
故选:C;
(4)40mL2mol/L的稀H2SO4,中n(H2SO4)=2mol/L×0.04L=0.08mol,则:
H2SO4~2NaOH~Na2SO4,
1 2 1
0.08mol0.16mol0.08mol
所以需要氢氧化钠物质的量为0.16mol,生成硫酸钠的物质的量为0.08mol;
需要2mol/L NaOH氢氧化钠的体积V=$\frac{0.16mol}{2mol/L}$=0.08L,则需要配制100mL溶液,需要氢氧化钠的质量=2mol/L×40g/mol×0.1L=8.0g;
故答案为:8.0;0.08mol.
点评 本题考查了配制一定物质的量浓度溶液及有关方程式的计算,明确配制原理和过程是解题关键,注意容量瓶、量筒的选择,题目难度中等.

 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:(部分反应物,产物略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:(部分反应物,产物略去).下列有关物质的推断正确的是( )| A. | 若甲为HNO3,则丁可能是Fe | B. | 若甲为AlCl3,则丁可能是氨水 | ||
| C. | 若甲为焦炭,则丁可能是SiO2 | D. | 若甲为NaOH 溶液,则丁可能是Cl2 |
| A. | 德国化学家维勒首次实现了人工合成有机物 | |
| B. | 原子吸收光谱常用来确定物质中含有非金属元素 | |
| C. | 所有金属元素都可以用焰色反应来确定其存在 | |
| D. | SO2能溶于水,水溶液能导电,所以SO2是电解质 |
 下列说法错误的是( )
下列说法错误的是( )| A. | 对甲苯丙烯酸的分子式为C10H10O2 | |
| B. | 对甲苯丙烯酸能发生的反应类型有加成、取代、氧化 | |
| C. | 对甲苯丙烯酸中所有碳原子有可能共平面 | |
| D. | 对甲苯丙烯酸能使酸性高锰酸钾溶液和溴水褪色,其原理相同 |
| A. | 向盛有10mL水的量筒中倒入浓硫酸即得稀硫酸 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 |
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |


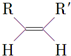 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$ .
. 在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验: