8. 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
(1)元素F的基态原子的电子排布式为1s22s22p63s23p5.
(2)分子甲的空间构型为正四面体,该分子中B的原子轨道发生的是sp3杂化.
(3)E单质属于分子晶体,E与A元素形成极性分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于离子晶体,其晶体中与D+最近且等距离的F-有6个.
(5)C元素的第一电离能(I1)>氧元素的第一电离能(I1)(填“<”或“>”或“=”).
0 172013 172021 172027 172031 172037 172039 172043 172049 172051 172057 172063 172067 172069 172073 172079 172081 172087 172091 172093 172097 172099 172103 172105 172107 172108 172109 172111 172112 172113 172115 172117 172121 172123 172127 172129 172133 172139 172141 172147 172151 172153 172157 172163 172169 172171 172177 172181 172183 172189 172193 172199 172207 203614
 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(2)分子甲的空间构型为正四面体,该分子中B的原子轨道发生的是sp3杂化.
(3)E单质属于分子晶体,E与A元素形成极性分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于离子晶体,其晶体中与D+最近且等距离的F-有6个.
(5)C元素的第一电离能(I1)>氧元素的第一电离能(I1)(填“<”或“>”或“=”).
 .
.
 .E的周期表中的位置:第三周期第ⅥA族.
.E的周期表中的位置:第三周期第ⅥA族.
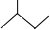
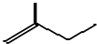 C5H10
C5H10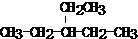
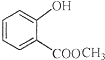 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. 50mL0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: