18.一定条件下,分别以KMnO4、KClO3、H2O2、HgO(HgO分解产生O2)为原料制取O2.当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比是( )
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
16.(1)反应N2O4(g)?2NO2(g);△H>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是K3>K1>K2..
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
20~40s内用N2O4表示的平均反应速率为0.002mol•L-1•s-1;298K时该反应的平衡转化率=75%;反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:
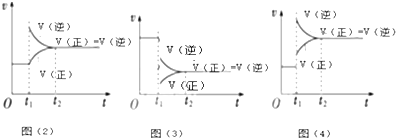
图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:

图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
15.20℃时对0.2mol•L-1的HA溶液中,改变下列条件一定能使HA的电离平衡正向移动的是( )
0 172006 172014 172020 172024 172030 172032 172036 172042 172044 172050 172056 172060 172062 172066 172072 172074 172080 172084 172086 172090 172092 172096 172098 172100 172101 172102 172104 172105 172106 172108 172110 172114 172116 172120 172122 172126 172132 172134 172140 172144 172146 172150 172156 172162 172164 172170 172174 172176 172182 172186 172192 172200 203614
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |

 (1)检验食盐中是否加碘,可利用如下反应:
(1)检验食盐中是否加碘,可利用如下反应:
 如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图如图2,请根据图示回答下列问题:
如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图如图2,请根据图示回答下列问题: