15.如表是元素周期表中的一部分,回答下列有关问题:
(1)写出下列元素符号:④Mg,⑥Si;
(2)画出④的离子结构示意图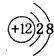 ;
;
(3)⑦⑧⑩⑪四种元素形成的离子,半径由大到小的顺序是S2->Cl->K+>Ca2+(填元素符号或化学式,下同);
(4)元素⑧的单质与水反应的化学方程式为Cl2+H2O=HCl+HClO;③元素与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
(5)③的最高价氧化物对应水化物与⑤的氧化物相互反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O;
(6)元素①的单质的电子式为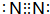 ,元素⑬最高价氧化物的电子式
,元素⑬最高价氧化物的电子式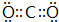 ;③与⑦两元素形成某种化合物,用电子式表示其形成过程
;③与⑦两元素形成某种化合物,用电子式表示其形成过程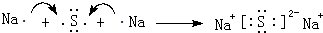 .
.
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑬ | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出④的离子结构示意图
 ;
;(3)⑦⑧⑩⑪四种元素形成的离子,半径由大到小的顺序是S2->Cl->K+>Ca2+(填元素符号或化学式,下同);
(4)元素⑧的单质与水反应的化学方程式为Cl2+H2O=HCl+HClO;③元素与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
(5)③的最高价氧化物对应水化物与⑤的氧化物相互反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O;
(6)元素①的单质的电子式为
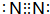 ,元素⑬最高价氧化物的电子式
,元素⑬最高价氧化物的电子式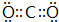 ;③与⑦两元素形成某种化合物,用电子式表示其形成过程
;③与⑦两元素形成某种化合物,用电子式表示其形成过程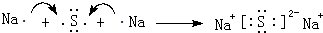 .
.
13.有一无色混合气体可能是由HCl、NO、NO2、CO2、NH3、H2中的一种或几种混合而成,将此气体通过盛有浓H2SO4时的洗气瓶时,气体体积减小.继续通过装有过氧化钠的干燥管,发现从出气口出来的气体显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍为一满试管液体,下列说法不正确的是( )
| A. | 原气体中一定含有NH3、CO2、NO | B. | 原气体中一定不含有HCl、H2、NO2 | ||
| C. | 原气体中可能含有HCl、H2 | D. | 原气体中CO2和NO物质的量比为3:2 |
11.L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如表:L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料.请回答下列问题:
(1)T原子的结构示意图为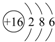 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
10.磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO4-、HPO42-、PO43-等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分数分布)也可能发生变化.图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线.用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2.下列说法不正确的是( )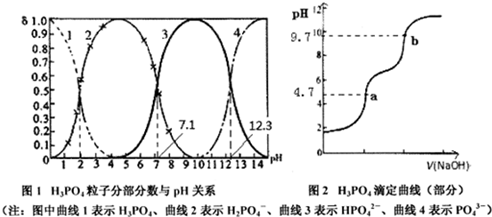

| A. | 从图1可知H3PO4、HPO42-、PO43-不能大量共存,0.01mol•L-1NaH2PO4溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | PO43-+H2O?0H-+HPO42-的平衡常数为10-1.7 | |
| C. | 从a点到b点的反应为H2PO4-+OH-=HPO42-+H2O,可以选用pH计确定滴定终点,无需添加指示剂 | |
| D. | 在Na2HPO4溶液中存在c(Na+)+c(OH-)=c(H+)+c(PO43-)+2c(HPO42-)+3c(H2PO4-)+4c(H3PO4) |
9.下列说法正确的是( )
| A. | 章鱼胺的结构为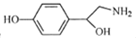 ,其分子式为C8H12NO2 ,其分子式为C8H12NO2 | |
| B. | 鸡蛋白可溶于水,加浓硫酸钠溶液和福尔马林均可使鸡蛋白溶液聚沉,但原理不同 | |
| C. | 葡萄糖、蔗糖、淀粉都属于糖类,三者互为同系物 | |
| D. | 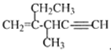 与足量H2反应的产物为3-甲基-2-乙基戊烷 与足量H2反应的产物为3-甲基-2-乙基戊烷 |
8.亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀毒.以下是用过氧化氢法生产亚氯酸钠的工艺流程图1:
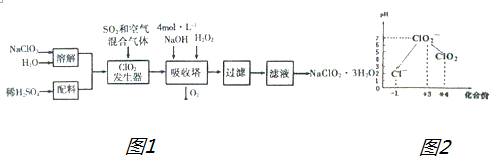
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O
②Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-20;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为2OH-+2ClO2+H2O2═2ClO2-+O2↑+2H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是edcf(填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.加热蒸发 f.洗涤干燥
(3)自来水厂也可用ClO2消毒杀菌,处理后的水中要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液进行滴定,发生2S2O32-+I2═S4O62-+2I-反应.
Ⅲ.加硫酸调节水样pH至1~3.操作时,不同pH环境中粒子种类如图2所示;请回答:
①操作Ⅱ滴定终点的现象是溶液蓝色刚好褪去,且保持30秒不变色.
②在操作Ⅱ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/LNa2S2O3溶液8ml,则水样中ClO2的浓度为0.54mg/L.
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.
下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2)(用化学式表示);体积相等,物质的浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:前者大(填“前者”“相等”或“后者大”).
②Na2S是常用的沉淀剂,某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时,此时体系中的S2-的浓度为6.3×10-13mol/L.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O
②Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-20;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为2OH-+2ClO2+H2O2═2ClO2-+O2↑+2H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是edcf(填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.加热蒸发 f.洗涤干燥
(3)自来水厂也可用ClO2消毒杀菌,处理后的水中要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液进行滴定,发生2S2O32-+I2═S4O62-+2I-反应.
Ⅲ.加硫酸调节水样pH至1~3.操作时,不同pH环境中粒子种类如图2所示;请回答:
①操作Ⅱ滴定终点的现象是溶液蓝色刚好褪去,且保持30秒不变色.
②在操作Ⅱ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/LNa2S2O3溶液8ml,则水样中ClO2的浓度为0.54mg/L.
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.
下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
②Na2S是常用的沉淀剂,某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时,此时体系中的S2-的浓度为6.3×10-13mol/L.
7.已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11.下列说法正确的是( )
0 171948 171956 171962 171966 171972 171974 171978 171984 171986 171992 171998 172002 172004 172008 172014 172016 172022 172026 172028 172032 172034 172038 172040 172042 172043 172044 172046 172047 172048 172050 172052 172056 172058 172062 172064 172068 172074 172076 172082 172086 172088 172092 172098 172104 172106 172112 172116 172118 172124 172128 172134 172142 203614
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |


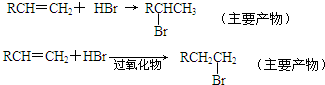
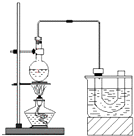 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图: