题目内容
10.磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO4-、HPO42-、PO43-等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分数分布)也可能发生变化.图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线.用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2.下列说法不正确的是( )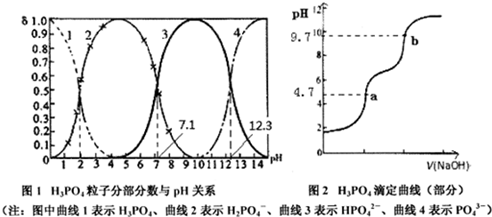
| A. | 从图1可知H3PO4、HPO42-、PO43-不能大量共存,0.01mol•L-1NaH2PO4溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | PO43-+H2O?0H-+HPO42-的平衡常数为10-1.7 | |
| C. | 从a点到b点的反应为H2PO4-+OH-=HPO42-+H2O,可以选用pH计确定滴定终点,无需添加指示剂 | |
| D. | 在Na2HPO4溶液中存在c(Na+)+c(OH-)=c(H+)+c(PO43-)+2c(HPO42-)+3c(H2PO4-)+4c(H3PO4) |
分析 A、H3PO4、HPO42-、PO43-能大量共存,NaH2PO4溶液中电离大于水解溶液显酸性;
B、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,Kh=$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$=$\frac{c(O{H}^{-})×c({H}^{+})×c(HP{{O}_{4}}^{-})}{c(P{{O}_{4}}^{3-})c({H}^{+})}$=$\frac{Kw}{Ka}$;
C、反应为H2PO4-+OH-=HPO42-+H2O,恰好反应后溶液PH=9.7,PH计可以测定溶液PH为小数点后一位;
D、由溶液中物料守恒和电荷守恒计算分析判断.
解答 解:A、H3PO4溶液中存在三步电离,H3PO4、HPO42-、PO43-能大量共存,NaH2PO4溶液中电离大于水解溶液显酸性,c(H2PO4-)>c(HPO42-)>c(H3PO4),故A错误;
B、图象分析可知,HPO42-?H++PO43-,Ka=c(H+)=10-12.3,Kh=$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$=$\frac{c(O{H}^{-})×c({H}^{+})×c(HP{{O}_{4}}^{-})}{c(P{{O}_{4}}^{3-})c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{1{0}^{-12.3}}$=10-1.7,故B正确;
C、PH计可以测定溶液PH为小数点后一位,从a点到b点的反应为H2PO4-+OH-=HPO42-+H2O,可以选用pH计确定滴定终点,无需添加指示剂,故C正确;
D、在Na2HPO4溶液中存在电荷守恒①C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-),溶液中存在物料守恒②C(Na+)=2C(H2PO4-)+2C(HPO42-)+2C(PO43-)+2C(H3PO4),②×2-①得到c(Na+)+c(OH-)=c(H+)+c(PO43-)+2c(HPO42-)+3c(H2PO4-)+4c(H3PO4),故D正确;
故选A.
点评 本题考查了电解质溶液中离子浓度大小,电荷守恒、物料守恒的计算分析应用,平衡常数概念的理解应用,掌握基础是解题关键,题目难度较大.

| A. | 丁烷 | B. | 2-甲基丙烷 | C. | 1-甲基丙烷 | D. | 甲烷 |
| A. | 含3.01×1023个CO32- | B. | 该Na2CO3的质量为106g | ||
| C. | 含0.5molNa+ | D. | 含1mol氧原子 |
| A. | 浓硫酸易挥发,从沉船中抽出的浓硫酸要密封保存 | |
| B. | 抽出的浓硫酸有很强的氧化性,不能直接保存在铁制容器中 | |
| C. | 在打捞时,如果盛装浓硫酸的舱室内进水,可能会发生爆炸 | |
| D. | 硫酸工业尾气虽然无害,但它的过度排放会造成温室效应 |

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2═2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑬ | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出④的离子结构示意图
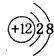 ;
;(3)⑦⑧⑩⑪四种元素形成的离子,半径由大到小的顺序是S2->Cl->K+>Ca2+(填元素符号或化学式,下同);
(4)元素⑧的单质与水反应的化学方程式为Cl2+H2O=HCl+HClO;③元素与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
(5)③的最高价氧化物对应水化物与⑤的氧化物相互反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O;
(6)元素①的单质的电子式为
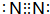 ,元素⑬最高价氧化物的电子式
,元素⑬最高价氧化物的电子式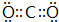 ;③与⑦两元素形成某种化合物,用电子式表示其形成过程
;③与⑦两元素形成某种化合物,用电子式表示其形成过程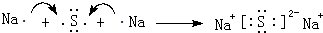 .
. | A. | 混合气体中14CO与12CO的分子数之比为14:15 | |
| B. | 混合气体中14CO与12CO的物质的量之比为1:1 | |
| C. | 混合气体中14CO与12CO的质量之比为14:15 | |
| D. | 混合气体中14CO与12CO的密度之比为1:1 |
| A. | 强电解质溶液的导电性比弱电解质溶液的导电性强 | |
| B. | BaSO4投入水中,导电性较弱,故它是弱电解质 | |
| C. | 弱电解质溶液中存在两种共价化合物分子 | |
| D. | 强电解质都是离子化合物,弱电解质都是共价化合物 |
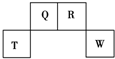 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题: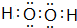 ,存在的化学键类型有非极性键和极性键.
,存在的化学键类型有非极性键和极性键.