题目内容
7.已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11.下列说法正确的是( )| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
分析 A、因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小;
B、NH4+结合OH-使氢氧化镁溶解平衡正向移动,Mg2+增大;
C、Ksp不随浓度变化,只与温度有关;
D、二者Ksp接近,加入NaF溶液后,Mg(OH)2和MgF2两种沉淀都会有.
解答 解:A、因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小,故A错误;
B、NH4+结合OH-使氢氧化镁溶解平衡正向移动,Mg2+增大,故B正确;
C、Ksp不随浓度变化,只与温度有关,故C错误;
D、二者Ksp接近,加入NaF溶液后,Mg(OH)2和MgF2两种沉淀都会有,故D错误.
故选B.
点评 本题考查难溶电解质的溶解平衡和沉淀转化,注意比较两种物质的溶度积大小,特别提醒是的不同物质的溶度积比较应是在化学式相似的情况下具有可比性.

练习册系列答案
相关题目
7.下列分离或提纯物质的方法正确的是( )
| A. | 用蒸馏的方法制取海盐 | |
| B. | 用过滤的方法除去Ba(OH)2溶液中含有的少量KOH | |
| C. | 用溶解、过滤、蒸发的方法分离实验室用KClO3制取O2的混合物 | |
| D. | 用加热、蒸发的方法可以除去NaCl固体中混有的CaCl2、MgCl2等杂质 |
4.在托盘天平左右两边分别放上等质量的足量的水和稀H2SO4,指针位于中心,向左烧杯中投入一定量的金属Na(2Na+2H2O═2NaOH+H2↑),右烧杯中投入一定量的金属Mg,充分反应后发现指针仍位于中心,则左盘和右盘转移的电子数之比为( )
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 不能确定 |
19.16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度500℃,最后容器内剩余的固体物质是( )
| A. | Na2CO3 | B. | Na2CO3、Na2O2 | C. | NaHCO3、Na2CO3 | D. | Na2CO3、NaOH |
16.下列关于有机物的叙述不正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 实验室中,可以用电石和饱和食盐水制取乙炔 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的浓溴水后过滤 | |
| D. | 分子式为C5H12O且可与金属钠放出H2的有机化合物有8种 |
 A、B、C、D、E是含有一种相同元素的五种物质,一定条件下可发生如图所示的转化.其中A是单质,B是常见的10电子体分子,E是含氧酸,回答问题.
A、B、C、D、E是含有一种相同元素的五种物质,一定条件下可发生如图所示的转化.其中A是单质,B是常见的10电子体分子,E是含氧酸,回答问题.
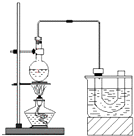 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图: