13.下列关于溶液的说法正确的是( )
| A. | 反应BaSO4(s)+4C(s)═BaS(s)+4CO(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 已知室温时氢氧化铁的溶度积常数为2.6×10-39,为除去某酸性CuCl2溶液中少量的氯化铁,可加入适量碱式碳酸铜调节溶液的pH到4,使Fe3+转化为氢氧化铁沉淀,此时溶液中的c(Fe3+)为2.6×10-8 mol/L | |
| C. | 相同物质的量浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O,c(NH4+)由大到小的顺序是:①>②>③ | |
| D. | 向Cu(OH)2悬浊液中加入胆矾,则平衡左移,氢氧化铜的溶解度不变 |
12.室温下进行的下列实验,不能达到预期目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 在滴有酚酞的Na2CO3溶液中,滴加入BaC12溶液,溶液红色逐渐褪去 | 证明Na2CO3溶液中存在水解平衡 |
| B | 将Al泊插入浓硝酸中,无现象 | 证明Al和浓硝酸不反应 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向同体积同浓度的H2O2溶液中,分别加入1mL同浓度的CuSO4、FeCl3溶液 | 比较Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是 ( )
| A. | 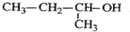 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 有机物 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 | |
| C. | 布洛芬结构如图所示 该物质可发生氧化、还原、加成、消去、取代反应 该物质可发生氧化、还原、加成、消去、取代反应 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
10.A、B、C、D、E四种短周期元素,元素A在地壳中含量最高,充有元素B单质蒸气的灯透雾能力强,常用于道路和广场的照明.E的最外层电子数与其电子总数比为3:8,D的单质常用作电脑的芯片材料.元素C的合金是日常生活中常用的合金( )
| A. | 元素B、C、D的简单氢化物中化学键类型相同 | |
| B. | 原子半径A>B>C>D>E | |
| C. | 由元素A、E形成的单质晶体类型相同 | |
| D. | AB形成的化合物中只可能含离子键 |
9.化学与生产、生活密切相关,下列说法不正确的是( )
0 171832 171840 171846 171850 171856 171858 171862 171868 171870 171876 171882 171886 171888 171892 171898 171900 171906 171910 171912 171916 171918 171922 171924 171926 171927 171928 171930 171931 171932 171934 171936 171940 171942 171946 171948 171952 171958 171960 171966 171970 171972 171976 171982 171988 171990 171996 172000 172002 172008 172012 172018 172026 203614
| A. | “辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料 | |
| B. | 新型氢动力计程车的投入使用有益于减少雾霾的产生 | |
| C. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 | |
| D. | 生物柴油是由动植物油脂与甲醇或乙醇,在酸或碱的催化及高温下进行反应,或在温和的条件下,用酶催化反应,生成的高级脂肪酸甲酯或乙酯 |


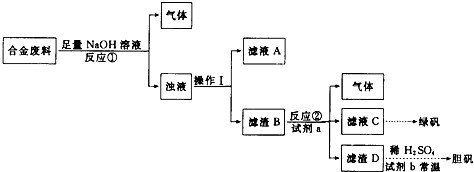
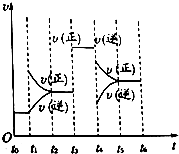 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题: 用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下: