题目内容
11.下列说法正确的是 ( )| A. | 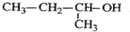 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 有机物 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 | |
| C. | 布洛芬结构如图所示 该物质可发生氧化、还原、加成、消去、取代反应 该物质可发生氧化、还原、加成、消去、取代反应 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
分析 A.该命名选取的主链错误,该有机物中含有羟基的最长碳链为4个碳,主链为丁醇,羟基在2号C;
B.根据该有机物的不饱和度进行判断其同分异构体能否含有醛基;
C.有机物含有羧基,具有酸性,可发生中和、酯化反应,结合有机物的结构解答该题;
D.苯、乙二醇(C2H6O2)组成的混合物中,苯中碳原子与氢原子个数之比为1:1,最简式为CH,乙二醇可以写成C2H2•2H2O形式,混合物看做CH、H2O混合,先根据氧元素的质量分数计算出水及CH元素的质量分数,再根据CH中碳元素与氢元素的质量之比为12:1,计算出化合物中碳元素的质量分数.
解答 解:A. 中含有羟基的最长碳链含有4个C,主链为丁醇,羟基在2号C,该有机物正确命名为:2-丁醇,故A错误;
中含有羟基的最长碳链含有4个C,主链为丁醇,羟基在2号C,该有机物正确命名为:2-丁醇,故A错误;
B. 的不饱和度为4,其同分异构体中若含有苯环,苯环的不饱和度为4,则其侧链为单键,不可能存在醛基,故B错误;
的不饱和度为4,其同分异构体中若含有苯环,苯环的不饱和度为4,则其侧链为单键,不可能存在醛基,故B错误;
C.分子中不含有能发生消去反应的官能团,故C错误;
D.苯、乙二醇(C2H6O2)组成的混合物中,苯中碳原子与氢原子个数之比为1:1,最简式为CH,乙二醇写成C2H2•2H2O形式,混合物可以看作CH、H2O混合,氧元素的质量分数为8%,则水的质量分数为:8%×$\frac{18}{16}$=9%,则CH的质量分数为:1-9%=91%,所以混合物中碳元素的质量分数为:91%×$\frac{12}{13}$=84%,故D正确;
故选D.
点评 本题考查了有机物的命名判断、有机物结构与性质、有机物分子中元素含量的计算等知识,题目难度中等,注意掌握常见有机物的结构与性质,明确有机物的命名原则,选项D为难点、易错点,注意掌握解题方法与技巧.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
2.工业精炼铜的如图所示(如图),下列有关说法正确的是( )


| A. | 右边电极材料为精铜 | |
| B. | 电解质溶液可选择CuSO4溶液 | |
| C. | 随着电解的进行,溶液中Cu2+浓度逐渐增加 | |
| D. | 阳极质量的减小量等于阴极质量的增加量 |
6.在一定温度下,向恒容密闭容器中加入2mol X和4mol Y,发生如下反应:X(s)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | B. | V正(X)=2V逆(Z) | ||
| C. | 容器内X、Y、Z的浓度相等 | D. | 容器内气体密度不变 |
3.下列说法正确的是( )
| A. | 二氧化硅溶于水显酸性 | |
| B. | 光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息 | |
| C. | 因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 | |
| D. | 作为宇航用的复合材料中,常用作基体的金属是镁、铝钛等黑色金属 |
1.某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)

(1)已知MgCO3与CaCO3性质相似,那么A中MgCO3的分解产物为MgO、CO2.
(2)装置C的作用是除CO2 ,处理尾气的方法为点燃.
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
信息:Fe2+遇K3[Fe(CN)6]溶液产生蓝色沉淀
①乙组得到的黑色粉末是Fe.
②经测定甲组中的黑色粉末有磁性,那么甲组步骤1中反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化成Fe3+,Fe3+遇SCN-显红色;溶液褪色可能的原因为SCN-被Cl2氧化.
④已知装置E是一种防倒吸装置,即防止F中的溶液因压强原因进入D中,导致D的玻璃管破裂,那么从实验安全的角度考虑,图中装置还应在装置B与C之间添加装置E.

(1)已知MgCO3与CaCO3性质相似,那么A中MgCO3的分解产物为MgO、CO2.
(2)装置C的作用是除CO2 ,处理尾气的方法为点燃.
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
信息:Fe2+遇K3[Fe(CN)6]溶液产生蓝色沉淀
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②经测定甲组中的黑色粉末有磁性,那么甲组步骤1中反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化成Fe3+,Fe3+遇SCN-显红色;溶液褪色可能的原因为SCN-被Cl2氧化.
④已知装置E是一种防倒吸装置,即防止F中的溶液因压强原因进入D中,导致D的玻璃管破裂,那么从实验安全的角度考虑,图中装置还应在装置B与C之间添加装置E.