14.现有10mL 0.1mol•L-1CH3COOH溶液,下列说法正确的是( )
| A. | 加入10 mL蒸馏水后,CH3COO-的数目减少,c(OH-)增大 | |
| B. | 加入V mL 0.1 mol•L-1 NaOH溶液后,若c(Na+)=c(CH3COO-),则V=10 | |
| C. | 加入10 mL 0.1 mol•L-1NH3•H2O溶液后,溶液中存在:c(CH3COO-)+c(CH3COOH)=c(H+)+c(N${H}_{4}^{+}$) | |
| D. | 将其逐滴加入10 mL 0.1 mol•L-1Na2CO3溶液中,混合溶液中存在:c(H+)+c(CH3COOH)+c(H2CO3)=c(OH-)+c(C${O}_{3}^{2-}$) |
13.在探究某地刚落下的酸雨成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 在酸雨试样中加入Ba(NO3)2溶液有白色沉淀,说明酸雨中一定含SO42- | |
| B. | 将酸雨试样浓缩后加入Cu和浓H2SO4,试管口有红棕色气体,逸出说明酸雨中可能含NO3- | |
| C. | 每隔1 h测定酸雨试样的pH,其pH先变小后不变,说明刚落下的酸雨中含SO32- | |
| D. | 用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在Na+ |
12.芫荽酮B的结构简式如图所示,下列有关该化合物的说法不正确的是( )
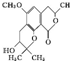

| A. | 每个分子中有2个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1 mol该物质最多可与含2 mol NaOH的水溶液反应 | |
| D. | 分子中有3种含氧官能团 |
11.下列有关说法正确的是( )
| A. | 铁件表面镀铬时,铁件与外电源正极相连 | |
| B. | 反应CaO(s)+3C(s)═CaC2(s)+CO(g)在高温下能自发进行,则该反应的△H<0 | |
| C. | 用湿润的pH试纸测定0.1 mol•L-1的Na2CO3溶液的pH,其pH将偏大 | |
| D. | 已知(CH3CO)2O与水反应可生成乙酸(△H<0),向0.1 mol•L-1的乙酸溶液中加入少量(CH3CO)2O,溶液的pH和乙酸的电离程度均减小 |
10.已知:①2H2O(l)═2H2(g)+O2(g)△H1
②H2(g)+Cl2(g)═2HCl(g)△H2
③4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H3
④N2(g)+3H2(g)?2NH3(g)△H4
⑤2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H5
下列关于上述反应焓变的判断正确的是( )
②H2(g)+Cl2(g)═2HCl(g)△H2
③4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H3
④N2(g)+3H2(g)?2NH3(g)△H4
⑤2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H2>0 | B. | △H3>0,△H4>0 | C. | 3△H2=△H4+△H5 | D. | △H3=-(△H1+2△H2) |
9.已知X、Y、Z中含同种元素,其中X、W是单质且有如图所示的转化关系,则X、W依次为( )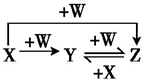
0 171817 171825 171831 171835 171841 171843 171847 171853 171855 171861 171867 171871 171873 171877 171883 171885 171891 171895 171897 171901 171903 171907 171909 171911 171912 171913 171915 171916 171917 171919 171921 171925 171927 171931 171933 171937 171943 171945 171951 171955 171957 171961 171967 171973 171975 171981 171985 171987 171993 171997 172003 172011 203614

| A. | Fe,Cl2 | B. | C,O2 | C. | N2,O2 | D. | S,O2 |
 二氧化氯被世界卫生组织(WHO)确认为第四代A1型消毒剂.
二氧化氯被世界卫生组织(WHO)确认为第四代A1型消毒剂. (NH4)2SO4•MnSO4•nH2O(硫酸锰铵)是浅粉色晶体,易溶于水,在农业上用作微量元素肥料,实验室由MnO2制备硫酸锰铵的实验步骤如下:
(NH4)2SO4•MnSO4•nH2O(硫酸锰铵)是浅粉色晶体,易溶于水,在农业上用作微量元素肥料,实验室由MnO2制备硫酸锰铵的实验步骤如下: