9.溶质的质量分数为a%,溶质的物质的量浓度为c mol/L的硫酸溶液,蒸发溶剂,恢复到原来温度,若溶质的质量分数变为2a,则溶质的物质的量浓度变为( )
| A. | 大于2cmol/L | B. | 小于2cmol/L | ||
| C. | 等于2cmol/L | D. | 在cmol/L和2cmol/L之间 |
8.已知A、B、C、D、四种元素都是元素周期表中前18号元素,原子序数依次增大.A、B、C、D四种元素在元素周期表中的相对位置如表所示.
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是第三周期ⅢA族;
(2)A和D的氢化物中,沸点较高的是HF(写化学式),原因是HF与HCl均形成分子晶体,HF的氢化物分子间可以形成氢键,而D的氢化物HCl不能形成氢键;
(3)写出B最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
| A | |||||||
| B | C | D |
(1)元素C在元素周期表中的位置是第三周期ⅢA族;
(2)A和D的氢化物中,沸点较高的是HF(写化学式),原因是HF与HCl均形成分子晶体,HF的氢化物分子间可以形成氢键,而D的氢化物HCl不能形成氢键;
(3)写出B最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
7.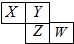 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
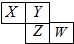 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | 原子半径由大到小排列顺序Z>X>Y | |
| B. | Y元素的两种同素异形体在常温下都是气体 | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
5.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)金属性最强的是Na,化学性质最不活泼的是Ar.
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(3)⑧的原子结构示意图为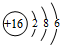 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
(4)若要证明非金属性:⑨>碘,可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为变蓝,即可证明.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(3)⑧的原子结构示意图为
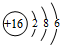 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.(4)若要证明非金属性:⑨>碘,可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为变蓝,即可证明.

4.下列烷烃中,既能由烯烃加氢得到也能由炔烃加氢得到的是( )
0 171508 171516 171522 171526 171532 171534 171538 171544 171546 171552 171558 171562 171564 171568 171574 171576 171582 171586 171588 171592 171594 171598 171600 171602 171603 171604 171606 171607 171608 171610 171612 171616 171618 171622 171624 171628 171634 171636 171642 171646 171648 171652 171658 171664 171666 171672 171676 171678 171684 171688 171694 171702 203614
| A. | 2-甲基丙烷 | B. | 2-甲基丁烷 | C. | 2,2-二甲基丙烷 | D. | 正丁烷 |
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
 .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.