题目内容
7.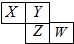 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | 原子半径由大到小排列顺序Z>X>Y | |
| B. | Y元素的两种同素异形体在常温下都是气体 | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
分析 X、Y、Z、W均为短周期元素,由元素位置可知,X、Y处于第二周期,Z、W处于第三周期,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则W原子最外层电子数为7,故W是Cl元素,可推知Z为S元素;Y为O元素;X为N元素,结合元素周期律解答.
解答 解:X、Y、Z、W均为短周期元素,由元素位置可知,X、Y处于第二周期,Z、W处于第三周期,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则W原子最外层电子数为7,故W是Cl元素,可推知Z为S元素;Y为O元素;X为N元素.
A.同周期元素的从左到右原子半径逐渐减小,原子核外电子层数越多,原子半径越大,则原子半径Z>X>Y,故A正确;
B.Y为O元素;Y元素的两种同素异形体为氧气和臭氧,在常温下都是气体,故B正确;
C.同周期元素从左到右元素的非金属性逐渐增强,所以非金属性W>Z,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以最高价氧化物对应水化物的酸性:W>Z,故C正确;
D.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->N3->O2-,即阴离子半径由大到小排列顺序Z>W>X>Y,故D错误,
故选:D.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意把握元素周期律的递变规律.

练习册系列答案
相关题目
17.下列各组物质能用分液的方法分离的是( )
| A. | CH3COOH和CH3CH2OH | B. | NaOH和水 | ||
| C. | 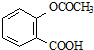 和水 和水 | D. | CH3CH2OH和水 |
18.将一定量的锌与100mL 18.5mol•L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 22.4L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中正确的是( )
| A. | 气体A为SO2 | B. | 反应中共消耗Zn 97.5 g | ||
| C. | 气体A中SO2和H2的体积比为4:1 | D. | 反应中共转移3 mol电子 |
19.已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A. | 该溶液的pH=4 | |
| B. | 由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 在该温度下加水稀释,溶液中$\frac{c({H}^{+})}{c(HA)}$减小 | |
| D. | 此酸的电离平衡常数约为1.0×10-7 |
14.在混合体系中,确认化学反应的先后顺序有利于问题的解决,下列反应的先后顺序的判断正确的是( )
| A. | 在含等物质的量的FeBr2和FeI2溶液中缓慢的通入氯气:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、Fe2+溶液中只加入Zn:Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2和KOH溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴滴加盐酸:AlO2-、Al(OH)3、OH-、CO32- |
 .
. .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.