10.下列有关0.1mol•L-1Na2CO3溶液的说法中错误的是( )
| A. | 其中钠离子的浓度为0.2mol•L-1 | |
| B. | 溶液中的OH-浓度大于H+浓度,HCO3-的浓度小于CO32-的浓度 | |
| C. | 溶液中Na+的浓度等于CO32-浓度的二倍 | |
| D. | 溶液中H2CO3分子的浓度为0 |
9.在水中加入下列物质,可使水的电离平衡正向移动的是( )
| A. | NaCl | B. | Na2CO3 | C. | NH4Cl | D. | NaHSO4 |
8.加盐酸或加入烧碱溶液使下列离子浓度都减小的是( )
| A. | HCO3- | B. | Al3+ | C. | CH3COO- | D. | H2PO4- |
7.下列微粒在溶液中能大量共存的是( )
| A. | NH4+、Fe2+、SO42-、NO3- | B. | Mg2+、K+、Cl-、AlO2- | ||
| C. | Al3+、Na+、SO42-、HS- | D. | Ca2+、H+、NO3-、SO32- |
6.下列离子水解的离子方程式中正确的是( )
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
5.常温下对pH<7的溶液的正确说法是( )
| A. | 一定是酸溶液 | B. | 一定是强酸弱碱盐的溶液 | ||
| C. | 一定是酸性溶液 | D. | 一定是能使甲基橙试液变红的溶液 |
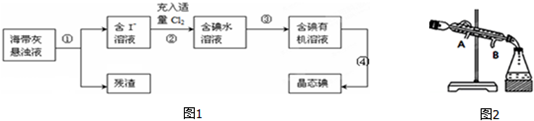
3.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)⑨的基态原子电子排布式1s22s22p63s23p64s1.
(2)⑦的基态原子电子排布图 .
.
(3)⑩的单质与水反应的化学方程式F2+2H2O=4HF+O2.
(4)表示①与⑦的化合物是由极性(填“极性”、“非极性”)键形成的非极性
(填“极性”、“非极性”)分子.
(5)②的单质的等电子中分子有CO;离子有C22-,它与钙离子形成的化合物与水反应的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑.
(6)②的氢化物极易溶于水,其中一个原因是它与水之间可形成氢键,写出它的水溶液中所有氢键的表达式N-H…N、O-H…O、N-H…O、O-H…N.
0 171506 171514 171520 171524 171530 171532 171536 171542 171544 171550 171556 171560 171562 171566 171572 171574 171580 171584 171586 171590 171592 171596 171598 171600 171601 171602 171604 171605 171606 171608 171610 171614 171616 171620 171622 171626 171632 171634 171640 171644 171646 171650 171656 171662 171664 171670 171674 171676 171682 171686 171692 171700 203614
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ⑩ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑨ | ⑧ |
(2)⑦的基态原子电子排布图
 .
.(3)⑩的单质与水反应的化学方程式F2+2H2O=4HF+O2.
(4)表示①与⑦的化合物是由极性(填“极性”、“非极性”)键形成的非极性
(填“极性”、“非极性”)分子.
(5)②的单质的等电子中分子有CO;离子有C22-,它与钙离子形成的化合物与水反应的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑.
(6)②的氢化物极易溶于水,其中一个原因是它与水之间可形成氢键,写出它的水溶液中所有氢键的表达式N-H…N、O-H…O、N-H…O、O-H…N.

 .
.