题目内容
5.常温下对pH<7的溶液的正确说法是( )| A. | 一定是酸溶液 | B. | 一定是强酸弱碱盐的溶液 | ||
| C. | 一定是酸性溶液 | D. | 一定是能使甲基橙试液变红的溶液 |
分析 常温下,酸性溶液pH<7,中性溶液pH=7,碱性溶液pH>7,如果溶液pH<7,该溶质中溶质可能是酸、强酸弱碱盐、强酸酸式盐,据此分析解答.
解答 解:常温下,酸性溶液pH<7,中性溶液pH=7,碱性溶液pH>7,如果溶液pH<7,该溶质中溶质可能是酸、强酸弱碱盐、强酸酸式盐,甲基橙的变色范围是3.1-4.4,则pH<7的溶液可能使甲基橙呈红色、橙色或黄色,
故选C.
点评 本题考查探究溶液酸碱性,为高频考点,涉及溶液中溶质及其性质、酸碱指示剂变色范围等知识点,注意:酸溶液一定呈酸性,但呈酸性的溶液中溶质不一定是酸,题目难度不大.

练习册系列答案
相关题目
15.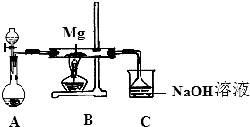 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是向反应后所得固体加过量2mol/L盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无气体产生).
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.
 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
| 序号 | 实验步骤 | 预期现象和结论 |
| 1 | 取少量反应后所得固体于试管中 | |
| 2 | 向试管中的固体慢慢滴加2mol/L 盐酸至过量,试管口塞上导管的单孔塞,并将导管通入盛有品红的试管中 | 若试管中的固体完全溶解,则丙同学推测正确.若试管中的固体未完全溶解,且品红溶液褪色,则乙同学推测正确. |
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.
10.下列有关0.1mol•L-1Na2CO3溶液的说法中错误的是( )
| A. | 其中钠离子的浓度为0.2mol•L-1 | |
| B. | 溶液中的OH-浓度大于H+浓度,HCO3-的浓度小于CO32-的浓度 | |
| C. | 溶液中Na+的浓度等于CO32-浓度的二倍 | |
| D. | 溶液中H2CO3分子的浓度为0 |
17.下列电子式或结构式错误的是( )
| A. | OH-的电子式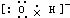 | B. | NH4Br的电子式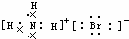 | C. | Na2O的电子式: | D. | Na+的电子式:Na+ |

 ,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.
,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.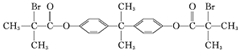 .
. .
. .
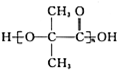
.
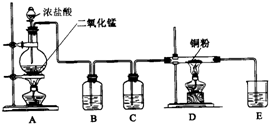 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.