1.常温下,将浓度均为0.05mol/L的Ba(0H)2和H2SO4溶液以2:1体积比混合(忽略体积变化),所得溶液的pH等于( )
| A. | pH=2.5 | B. | pH=1.5 | C. | pH=12.5 | D. | pH=11.5 |
20.水解原理在生产和生活中都具有重要的用途.下列应用与盐类的水解无关的是( )
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | 热的纯碱溶液用于清洗油污 | |
| C. | 次氯酸钠常用作消毒剂 | |
| D. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
19.加入下列物质对水的电离平衡不产生影响的是( )
| A. | NaI | B. | NaHSO4 | C. | CH3COONH4 | D. | KF |
18.下列属于塑料制品的是( )
| A. | 汽车轮胎 | B. | 涤纶 | C. | 聚乙烯制品 | D. | 玻璃钢 |
17.下列物质中互为同分异构体的是( )
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | C. | 淀粉和纤维素 | D. | 果糖和麦芽糖 |
16.氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是( )
| A. | 由热电站提供电力电解水产生氢 | |
| B. | 用铁和盐酸反应放出氢气 | |
| C. | 利用太阳能在一定条件下使水分解产生氢气 | |
| D. | 以焦炭和水制取水煤气(含CO和H2)后分离出氢气 |
15.在恒压容器中盛有2mol PCl5,加热到200℃时发生如下反应,PCl5(g)?PCl3(g)+Cl2(g),反应达到平衡有PCl5 0.4mol,此时若移走1mol PCl3和1mol Cl2,相同温度下达到平衡状态时,PCl5的物质的量为( )
| A. | 0.4mol | B. | 大于0.2mol小于0.4mol | ||
| C. | 0.2mol | D. | 小于0.2mol |
14.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
| A. | 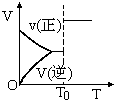 aX(g)+bY(g)?cZ(g)密闭容器中反应达平衡,T0时条件改变如图所示,则改变的条件一定是加入催化剂 | |
| B. |  L(s)+aG(g)?bR(g)反应达到平衡时,外界条件对平衡影响如图所示,若P1>P2,则a>b | |
| C. | 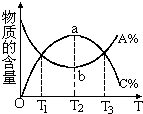 aA+bB?cC物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应 | |
| D. | 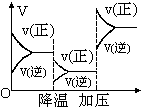 A+2B?2C+3D反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
13.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①硫酸铜固体 ②KNO3溶液 ③氯化钾溶液 ④CH3COONa固体 ⑤同浓度的硫酸.
①硫酸铜固体 ②KNO3溶液 ③氯化钾溶液 ④CH3COONa固体 ⑤同浓度的硫酸.
| A. | ①⑤ | B. | ③④ | C. | ②③ | D. | ②④ |
12.利用磷肥生产中形成的副产物石膏(CaSO4•2H2O)生产硫酸,同时得到硫酸钾肥料和氯化钙水合物储热材料,无论是从经济效益、资源综合利用还是从环境保护角度都具有重要意义.以下是有关的工艺流程示意图.
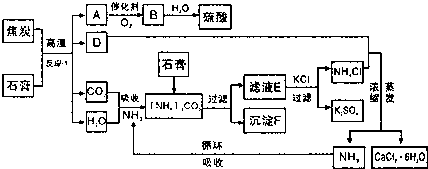
请回答下列问题:
(1)反应①的化学方程式是CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+CO2↑+4H2O↑;
(2)沉淀F含有CaCO3和CaSO4•2H2O(填化学式)等物质,可作为生产水泥的主要原料;
(3)检验滤液E中含有CO2-3的方法是取少许滤液滴加到盐酸中产生气泡(用简要文字回答);
(4)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,主要选择的依据是cd(填序号)
a.能导电 b.易溶于水 c.熔点较低(29℃熔化) d.无毒
(5)工业制硫酸的精制炉气中,SO2平衡转化率与温度及压强关系如下表:
分析上表数据,你认为工业上制硫酸中SO2的催化氧化的适宜条件是常压、400-500℃、催化剂的条件下.
0 171284 171292 171298 171302 171308 171310 171314 171320 171322 171328 171334 171338 171340 171344 171350 171352 171358 171362 171364 171368 171370 171374 171376 171378 171379 171380 171382 171383 171384 171386 171388 171392 171394 171398 171400 171404 171410 171412 171418 171422 171424 171428 171434 171440 171442 171448 171452 171454 171460 171464 171470 171478 203614

请回答下列问题:
(1)反应①的化学方程式是CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+CO2↑+4H2O↑;
(2)沉淀F含有CaCO3和CaSO4•2H2O(填化学式)等物质,可作为生产水泥的主要原料;
(3)检验滤液E中含有CO2-3的方法是取少许滤液滴加到盐酸中产生气泡(用简要文字回答);
(4)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,主要选择的依据是cd(填序号)
a.能导电 b.易溶于水 c.熔点较低(29℃熔化) d.无毒
(5)工业制硫酸的精制炉气中,SO2平衡转化率与温度及压强关系如下表:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |