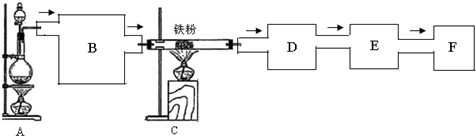
题目内容
13.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )①硫酸铜固体 ②KNO3溶液 ③氯化钾溶液 ④CH3COONa固体 ⑤同浓度的硫酸.
| A. | ①⑤ | B. | ③④ | C. | ②③ | D. | ②④ |
分析 铁和盐酸反应的实质是:Fe+2H+=Fe2++H2↑,故要减缓反应速率,可减小氢离子的浓度,Fe过量则酸能完全反应,生成氢气由盐酸决定,要想不影响生成氢气的总量,必须保证与铁反应的氢离子的物质的量不变,以此来解答.
解答 解:①加硫酸铜固体,与铁反应置换出铜形成原电池,反应速率加快,故A不符合;
②加KNO3溶液,形成了硝酸,与金属反应不产生氢气,生成氢气的总量会减少,故②不符合;
③加氯化钾溶液,可减小氢离子的浓度,故减缓了反应速率,氢离子的物质的量不变,则生成氢气不变,故③符合;
④加CH3COONa固体,与盐酸反应生成醋酸,溶液中已电离出的氢离子浓度减小,但物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故④符合;
⑤加同浓度的硫酸,氢离子的浓度及其物质的量都增大,所以反应速率和氢气的量都增大,故⑤不符合;
故选B.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由盐酸决定,把握浓度对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
1.钨是重要的战略元素,在地壳中含量仅为0.007%,我国钨储量约占世界总储量的55%,居首位.从经过预处理的钨矿原料(主要成分FeWO4、MnWO4,还含Si、P、As的化合物等)制备WO3的流程如下:
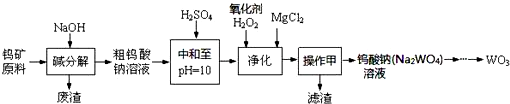
回答下列问题:
(1)上述流程中操作甲的名称是过滤.
(2)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示.下列说法正确的是A.
钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系图
注:碱用量的单位为理论量的倍数
A.增大NaOH浓度浸出率增大 B.增大碱用量浸出率一定增大
C.增大碱用量浸出率一定减小 D.原料中CaO的含量增大则浸出率增大
(3)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等.则“净化”时,加入H2O2反应的离子方程式HAsO32-+H2O2=HAsO42-+H2O.
(4)在“净化”阶段,若常温下所得溶液pH=9.5,为不产生Mg(OH)2沉淀,溶液中c(Mg2+)应不超过5.6×10-3mol•L-1.[Ksp(Mg(OH)2=5.6×10-12]
(5)上述流程中所得的产品质量较好,但有废物排出,排出的废水中含有的主要物质是Na2SO4、NaCl(填化学式).
(6)用酸性介质中的碳化钨(WC)的阳极氧化法,可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,阳极析出钨酸并放出无污染的气体.该阳极反应式为WC+6H2O-10e-=H2WO4+CO2↑+10H+.

回答下列问题:
(1)上述流程中操作甲的名称是过滤.
(2)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示.下列说法正确的是A.
钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系图
| w(CaO)% NaOH浓度& 浸出率% 碱用量c/mol•L-1 | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
A.增大NaOH浓度浸出率增大 B.增大碱用量浸出率一定增大
C.增大碱用量浸出率一定减小 D.原料中CaO的含量增大则浸出率增大
(3)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等.则“净化”时,加入H2O2反应的离子方程式HAsO32-+H2O2=HAsO42-+H2O.
(4)在“净化”阶段,若常温下所得溶液pH=9.5,为不产生Mg(OH)2沉淀,溶液中c(Mg2+)应不超过5.6×10-3mol•L-1.[Ksp(Mg(OH)2=5.6×10-12]
(5)上述流程中所得的产品质量较好,但有废物排出,排出的废水中含有的主要物质是Na2SO4、NaCl(填化学式).
(6)用酸性介质中的碳化钨(WC)的阳极氧化法,可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,阳极析出钨酸并放出无污染的气体.该阳极反应式为WC+6H2O-10e-=H2WO4+CO2↑+10H+.
18.下列属于塑料制品的是( )
| A. | 汽车轮胎 | B. | 涤纶 | C. | 聚乙烯制品 | D. | 玻璃钢 |
2.下列离子方程式正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | NaOH溶液与醋酸反应:H++OH-═H2O | |
| C. | 稀H2SO4与纯碱溶液反应:2H++Na2CO3═2Na++CO2↑+H2O | |
| D. | 少量二氧化碳与氢氧化钾反应:CO2+2OH-═CO32-+H2O |
 反应体系中共有六种物质:NH4Cl、
反应体系中共有六种物质:NH4Cl、 FeCl3、N2、Fe2O3、Fe和X。
FeCl3、N2、Fe2O3、Fe和X。