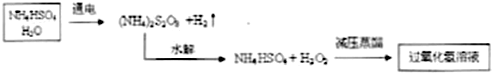题目内容
1.常温下,将浓度均为0.05mol/L的Ba(0H)2和H2SO4溶液以2:1体积比混合(忽略体积变化),所得溶液的pH等于( )| A. | pH=2.5 | B. | pH=1.5 | C. | pH=12.5 | D. | pH=11.5 |
分析 先计算出氢离子、氢氧根离子浓度,然后根据等体积混合后酸碱过量情况计算出反应后的溶液中氢离子浓度,最后根据溶液pH的表达式计算出溶液的pH.
解答 解:0.05mol/L的氢氧化钡溶液中氢氧根离子浓度为:c(OH-)=2c(Ba(OH)2)=0.1mol/L,0.05mol/L的H2SO4溶液中氢离子浓度为:c(H+)=2c(H2SO4)=0.1mol/L,两溶液以2:1体积比混合混合后氢氧根离子过量,
则反应后溶液中氢氧根离子浓度为:c(OH-)=$\frac{0.1×2-0.1×1}{3}$mol/L=$\frac{0.1}{3}$mol/L,
溶液中氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{\frac{0.1}{3}}$=3×10-13mol/L,
混合液的pH为:pH=-lgc(H+)=13-lg3≈12.5,
故选C.
点评 本题考查酸碱混合液pH的计算,题目难度不大,试题侧重基础知识的考查,注意酸碱物质的量的计算和过量问题,把握好溶液酸碱性与溶液pH的计算公式.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
16.氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是( )
| A. | 由热电站提供电力电解水产生氢 | |
| B. | 用铁和盐酸反应放出氢气 | |
| C. | 利用太阳能在一定条件下使水分解产生氢气 | |
| D. | 以焦炭和水制取水煤气(含CO和H2)后分离出氢气 |
10.组成中有氢氧根的盐叫做碱式盐,酸根中含有氢元素的盐叫做酸式盐下列盐中属于碱式盐的是( )
| A. | KHSO4 | B. | Cu2(OH)2CO3 | C. | Ca(H2PO4)2 | D. | NH4NO3 |
11.下列说法中不正确的是( )
| A. | 在甲、乙两烧杯的溶液中,共含有Cu2+、K-、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是:K+、OH-、CO32- | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的BaO2固体后,CH3COO-浓度变化最小 | |
| D. | 常温下水电离出的c(OH-)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |