5.下列单质或化合物性质的描述正确的是( )
| A. | NaHCO3的热稳定性大于Na2CO3 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,体现了二氧化硫的漂白性 | |
| D. | 浓H2SO4在加热条件下可与铜反应,浓硫酸表现了酸性和强氧化性 |
4.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下32g O2和O3所含的原子数为2NA | |
| B. | 标准状况下22.4L CCl4所含的分子数为NA | |
| C. | 1mol/L CaCl2溶液中所含的Cl-离子数为2NA | |
| D. | 56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
3.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
| A. | 稀盐酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
2.下列关于物质用途的叙述中不正确的是( )
| A. | 单质硅可用于制造光纤和太阳能电池 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 食盐是氯碱工业的基础原料 | |
| D. | Na2O2用作呼吸面具的供氧剂 |
1.下列各组物质中分子数一定相同的是( )
| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
20.下列各组名词或现象中,三者间没有逐级因果关系的是( )
| A. | 汽车尾气的大量排放--光化学污染--咳嗽和气喘者增多 | |
| B. | 生活污水任意排放--空气中CO2浓度增大--温室效应 | |
| C. | 含磷洗衣粉的大量使用--水体富营养化--水栖生物大量死亡 | |
| D. | 劣质装饰材料的大量使用--甲醛、苯等释放--致癌 |
18.下列各组元素性质的递变情况错误的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正价依次增大 | |
| C. | Na、K、Rb电负性逐渐减小 | |
| D. | P、S、Cl元素最高价含氧酸酸性依次增强 |
17.以淀粉或者乙烯为原料均可合成乙酸乙酯等很多的化工产品,其合成路线如图1所示:

已知:R-CHO$\stackrel{O_{2},△}{→}$R-COOH
(1)A的分子式为C6H12O6C试剂是新制Cu(OH)2悬浊液.加B溶液的作用为中和H2SO4.
(2)反应⑥的反应类型为加成反应,E物质的官能团名称为羧基,F为高分子化合物,可以用来制造多种包装材料,其结构简式是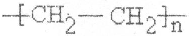 .
.
(3)写出反应③和⑤的化学反应方程式
③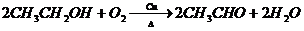
⑤C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(4)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:CH2=CH2+Cl2+Ca(OH)2→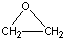 +CaCl2+H2O
+CaCl2+H2O
工艺二:2CH2=CH2+O2$\stackrel{Ag}{→}$2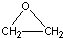
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,在实际生产中,应采
用工艺二(填“工艺一”或“工艺二”)更环保、更经济.
(5)实验室制备乙酸乙酯中使用了浓硫酸,为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图2所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如表:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是3mL和4mol•L-1.
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
0 171232 171240 171246 171250 171256 171258 171262 171268 171270 171276 171282 171286 171288 171292 171298 171300 171306 171310 171312 171316 171318 171322 171324 171326 171327 171328 171330 171331 171332 171334 171336 171340 171342 171346 171348 171352 171358 171360 171366 171370 171372 171376 171382 171388 171390 171396 171400 171402 171408 171412 171418 171426 203614

已知:R-CHO$\stackrel{O_{2},△}{→}$R-COOH
(1)A的分子式为C6H12O6C试剂是新制Cu(OH)2悬浊液.加B溶液的作用为中和H2SO4.
(2)反应⑥的反应类型为加成反应,E物质的官能团名称为羧基,F为高分子化合物,可以用来制造多种包装材料,其结构简式是
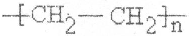 .
.(3)写出反应③和⑤的化学反应方程式
③
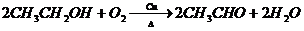
⑤C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(4)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:CH2=CH2+Cl2+Ca(OH)2→
 +CaCl2+H2O
+CaCl2+H2O工艺二:2CH2=CH2+O2$\stackrel{Ag}{→}$2

根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,在实际生产中,应采
用工艺二(填“工艺一”或“工艺二”)更环保、更经济.
(5)实验室制备乙酸乙酯中使用了浓硫酸,为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图2所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
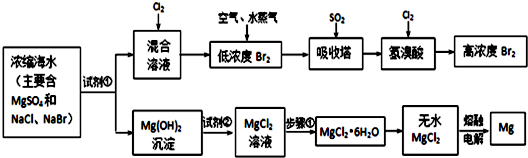
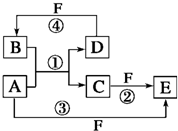 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)